Tantal [ˈtantal] ist ein chemisches Element mit dem Symbol Ta und der Ordnungszahl 73; im Periodensystem steht es in der fünften Nebengruppe oder Vanadiumgruppe. Es ist ein selten vorkommendes, duktiles, graphitgraues, glänzendes Übergangsmetall. Tantal wird vorwiegend für Kondensatoren mit hoher Kapazität bei gleichzeitig geringer Größe verwendet. Da das Metall ungiftig und gegen Körperflüssigkeiten inert ist, wird es auch für Implantate, etwa als Knochennagel, eingesetzt.
Das Element wurde 1802 von Anders Gustav Ekeberg in einem finnischen Columbit-Erz entdeckt. Er trennte ein sehr beständiges Oxid (Tantal(V)-oxid) ab, das sich in keiner Säure löste. Benannt ist es nach Tantalos, einer Figur aus der griechischen Mythologie. Der Grund für diesen Namen liegt nach Ekeberg darin, dass das sehr beständige Oxid „schmachten muss und seinen Durst nicht löschen kann, wie Tantalus in der Unterwelt“.
Nahezu gleichzeitig fand Charles Hatchett in einem kolumbianischen Erz das sehr ähnliche Columbium. Die beiden Elemente wurden bis 1844 für identisch gehalten, als Heinrich Roseerkannte, dass in den Columbit-Erzen zwei verschiedene Elemente vorlagen, nämlich Tantal und Columbium. Letzteres nannte er Niob.
Nach der Entdeckung des neuen Elements wurde von verschiedenen Chemikern versucht, Tantal auch elementar darzustellen. Der erste, der elementares Tantal durch Reduktion vonTantalfluorid mit Kalium darstellte, war 1815 Jöns Jakob Berzelius. Allerdings bestand sein Metall wie das von Rose dargestellte Tantal nur zu 50 % aus Tantal. Henri Moissan versuchte 1902, Tantal im elektrischen Ofen herzustellen, sein Produkt war jedoch durch den enthaltenen Kohlenstoff sehr hart und spröde.
Der erste, der reines, duktiles Tantal herstellen konnte, war Werner von Bolton 1903. Er erreichte dies durch Reduktion der glühenden Oxide im Vakuum sowie durch Schmelzen von unreinem Tantalmetall im Vakuum und elektrischem Flammenbogen.
Die erste Anwendung des neuen Elementes war diejenige als Glühfaden in Glühlampen. Der Grund für den Wechsel vom vorher verwendeten Osmium zu Tantal lag darin, dass es leichter zu verarbeiten ist und eine höhere mögliche Nutztemperatur bis zu 2300 °C besitzt. Später wurde es durch Wolfram ersetzt, das einen noch höheren Schmelzpunkt besitzt und damit ein dem Sonnenlicht näheres Lichtspektrum und eine höhere Lichtausbeute ermöglicht.
Im Jahr 1922 wurde mit der Verwendung in Gleichrichtern und ein Jahr später in Radioröhren ein neuer Einsatzzweck für Tantal gefunden.
Vorkommen
Tantal ist mit einem Gehalt von 2 ppm in der kontinentalen Erdkruste bzw. 8 ppm in der Erdhülle ein seltenes Element auf der Erde. Die Häufigkeit ist vergleichbar mit der von Arsen und Germanium. Innerhalb der Gruppe nimmt die Häufigkeit jeweils um eine Zehnerpotenz ab. Tantal kommt nicht gediegen, sondern nur in Form seiner Verbindungen in verschiedenen Mineralen vor. Auf Grund der Ähnlichkeit der beiden Elemente enthalten Tantalerze stets Niob und umgekehrt (Vergesellschaftung). Die wichtigsten Minerale sind die der Columbit- und Tapiolit-Reihe, in der verschiedene Minerale mit der allgemeinen Formel (Mn, Fe2+)(Nb,Ta)2O6 zusammengefasst werden. Tantalreiche Columbite werden auch als Tantalite bezeichnet. Beispiele für Tantalhaltige Minerale dieser Reihen sind Ferrotapiolith (Fe2+, Mn2+)(Ta, Nb)2O6 und Manganotantalit MnTa2O6. Häufig werden diese Erze auch als Coltan bezeichnet. Seltenere Minerale sind Mikrolith oder Thoreaulith.
Die wichtigsten Förderländer von Tantalerzen waren 2007 Australien mit 850 Tonnen und Brasilien mit 250 Tonnen. Daneben findet man Coltan auch in Kanada und verschiedenen afrikanischen Ländern wie Äthiopien, Mosambik und Ruanda. In den Medien bekannt geworden sind die Vorkommen im Osten der Demokratischen Republik Kongo, die im Kongokrieg 1996–2008 stark umkämpft waren.
Gewinnung und Darstellung
Da in den zur Tantalgewinnung verwendeten Erzen Tantal und Niob immer zusammen vorliegen, müssen sie für eine Gewinnung der Reinmetalle getrennt werden. Dies wird durch die große Ähnlichkeit der beiden Elemente erschwert.
Das erste Verfahren zur Trennung wurde 1866 von Jean Charles Galissard de Marignac entwickelt. Er nutzte dabei die unterschiedliche Löslichkeit der beiden Elemente in verdünnter Flusssäure. Tantal bildet das gering lösliche K2TaF7, Niob das gut lösliche K3NbOF5 · 2 H2O.
Das heute technisch verwendete Verfahren beruht auf Extraktion und nutzt die unterschiedliche Löslichkeit von komplexen Fluorsalzen in Wasser und bestimmten organischen Lösungsmitteln. Dabei wird das Erzgemisch zunächst in konzentrierter Flusssäure oder Gemischen aus Fluss- und Schwefelsäure gelöst. Es bilden sich die komplexen Fluoride [NbOF5]2− und [TaF7]2−. Nachdem unlösliche Bestandteile abfiltriert wurden, kann die Trennung durch Flüssig-Flüssig Extraktion mit Hilfe von Methylisobutylketon erfolgen. Wird die Lösung mit Methylisobutylketon versetzt, gehen die Niob- und Tantalkomplexe in die organische Phase über, während andere Elemente, wie Eisen, oder Manganin der wässrigen Phase zurückbleiben. Bei Zugabe von Wasser zur abgetrennten organischen Phase, löst sich nur der Niobkomplex in diesem, das Tantal bleibt im Methylisobutylketon zurück.
Das Tantal kann mit Hilfe von Kaliumfluorid als schwerlösliches K2[TaF7] gefällt werden. Die Reduktion zu elementarem Tantal erfolgt meist durch Natrium.
![\mathrm{K_2[TaF_7] + 5\ Na \longrightarrow Ta +5\ NaF + 2\ KF}](https://upload.wikimedia.org/wikipedia/de/math/4/0/8/4082df7e6f3cde8acd65ddf4230284e5.png) Reduktion mit Natrium
Reduktion mit Natrium
Eine mögliche Alternative zur Extraktion besteht in der fraktionierten Destillation. Dazu werden die unterschiedlichen Siedepunkte der beiden Chloride Niobpentachlorid und Tantalpentachlorid genutzt. Diese können bei hohen Temperaturen aus den Erzen mit Chlor und Koks gewonnen werden. Nach der Trennung wird das Tantalchlorid ebenfalls mit Natrium zum Metall reduziert.
Neben den Columbit-Tantalit-Erzen sind Schlacken aus der Zinnverhüttung eine wichtige Quelle für die Tantalgewinnung (enthalten wenige Prozent Tantal).
Physikalische Eigenschaften
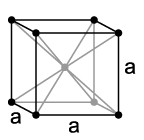
Kristallstruktur von Tantal,a = 330,3 pm
Tantal ist ein deutlich lilagraues, stahlhartes (Vickershärte: 60–120 HV), hochschmelzendes Schwermetall, das in den meisten seiner Eigenschaften dem Niob ähnelt. Es kristallisiert in einer kubisch-raumzentrierten Kristallstruktur. Mit einem Schmelzpunkt von etwa 3000 °C besitzt Tantal den höchsten Schmelzpunkt aller Elemente nach Wolfram, Kohlenstoff und Rhenium. Ist im Metall nur eine geringe Menge Kohlenstoff oder Wasserstoff eingelagert, steigt der Schmelzpunkt deutlich an. Tantalcarbid besitzt mit einem Schmelzpunkt von 3880 °C einen der höchsten Schmelzpunkte aller Substanzen.
Unterhalb einer Sprungtemperatur von 4,3 Kelvin wird Tantal zum Supraleiter.
Während reines Tantal duktil ist und sich stark dehnen lässt (Zugfestigkeit: 240 MPa), verändern schon kleine Mengen Beimengungen an Kohlenstoff oder Wasserstoff die mechanische Festigkeit deutlich. Das Material wird spröde und schwer zu verarbeiten. Man nutzt diesen Effekt zur Herstellung von Tantalpulver. Es wird in der Technik mit Wasserstoff beladen und somit versprödet, dann entsprechend zerkleinert und bei höherer Temperatur wieder vom Wasserstoff ausgeheizt bzw. befreit.
Chemische Eigenschaften
Tantal ist ein unedles Metall und reagiert bei hohen Temperaturen mit den meisten Nichtmetallen, wie Sauerstoff, den Halogenen oder Kohlenstoff. Bei Raumtemperatur ist das Metall allerdings durch eine dünne Schicht aus Tantal(V)-oxid geschützt und damit passiviert. Eine Reaktion findet erst ab einer Temperatur von etwa 300 °C statt.
In den meisten Säuren ist Tantal wegen der Passivierung nicht löslich, sogar Königswasser vermag das Metall nicht zu lösen. Angegriffen wird Tantal nur von Flusssäure, Oleum (einer Mischung von Schwefelsäure und Schwefeltrioxid) und Salzschmelzen.
Isotope
Es sind insgesamt 30 Isotope sowie 26 Kernisomere von 155Ta bis 185Ta bekannt. Natürliches Tantal besteht fast ausschließlich (zu 99,988 %) aus dem Isotop 181Ta. Daneben kommt zu 0,012 % das Kernisomer 180mTa vor. Obwohl dieses theoretisch radioaktiv sein kann, wurde bisher kein Zerfall beobachtet. Die Halbwertszeit muss daher über 1 · 1015 Jahre betragen.
Verwendung
Der größte Teil des Tantals (weltweite Jahresproduktionsmenge 1.400 t) wird für sehr kleine Kondensatoren mit hoher Kapazität verwendet. 2007 wurden 60 % des Tantals für die Herstellung von Kondensatoren gebraucht. DieseTantal-Elektrolytkondensatoren werden überall in der modernen Mikroelektronik, beispielsweise für Mobiltelefone und im Automobilbau, eingesetzt. Die Wirkung beruht auf der selbst in sehr dünner Ausführung noch stabilen und sicher isolierenden Tantaloxidschicht auf der Oberfläche der aufgewickelten Tantalfolie. Je dünner die Schicht zwischen den Elektroden ist, desto höher wird die Kapazität bei gleich bleibender Folienfläche; zudem hat Tantaloxid eine extrem hohe Permittivität, die ebenfalls die Kapazität erhöht.
Da Tantal nicht giftig ist und nicht mit Körpergewebe oder -flüssigkeiten reagiert, wird elementares Tantal für medizinische Implantate und Instrumente eingesetzt. Es werden beispielsweise Knochennägel, Prothesen, Klammern undKieferschrauben aus Tantal gefertigt. Daneben ist es ein auf Grund der hohen Kosten wenig eingesetztes Röntgenkontrastmittel.
In der chemischen Industrie wird Tantal wegen seiner Beständigkeit eingesetzt. Es dient als Auskleidungsmaterial für Reaktionskessel und wird für Wärmeaustauscher und Pumpen verwendet. Für diese Zwecke wird meist kein reines Tantal, sondern Legierungen, die 2,5–10 % Wolfram enthalten, verwendet. Diese sind stabiler und widerstandsfähiger als reines Tantal. Gleichzeitig bleibt die erwünschte Duktilität erhalten. Weitere Verwendungszwecke sind Laborgeräte, Spinndüsen und die Kathoden von Elektronenröhren. Hier kommt Tantal zugute, dass es in der Lage ist bei 800 °C bis zu 740 Volumenteile Gase aufzunehmen (Getterwirkung), was ein hohes Vakuum in den Röhren gewährleistet.
Superlegierungen, die im Bau von Turbinen und Flugzeugtriebwerken eingesetzt werden, enthalten bis zu 9 % Tantal. So erhöht der Zusatz von 3–4 % Tantal zu einer Nickel-Superlegierung die Stärke des Materials bei hohen Temperaturen.
Sicherheitshinweise
Unter Laborbedingungen verursacht der Umgang mit Tantal und seinen Verbindungen normalerweise keine Probleme. Elementares Tantal wie auch Tantalverbindungen sind nicht toxisch. Es gibt aber vage Hinweise auf krebsauslösendes Verhalten einiger Tantalverbindungen. Von Tantalpulver und -staub geht – wie auch von anderen fein verteilten Metallen – eine hohe Feuer- und Explosionsgefahr aus.
Verbindungen
Tantal(V)-oxid Ta2O5 ist ein weißes Pulver, das zur Herstellung hochlichtbrechender Gläser und spezieller Kristallmaterialien verwendet wird.
Tantalcarbid TaC dient mit seiner Schmelztemperatur von 3880 °C und einer Härte, die fast die eines Diamanten erreicht, als Schutzschicht auf hochwarmfesten Legierungen in Triebwerken und Schneidwerkzeugen.
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name, Symbol,Ordnungszahl | Tantal, Ta, 73 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Übergangsmetalle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 5, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | grau | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an derErdhülle | 8 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 180,9479 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 145 (200) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 138 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 761 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1500 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 16,65 g/cm3 (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( = 1,8 · 10−4) = 1,8 · 10−4) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 3290 K (3017 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 5731 K (5458 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 10,85 · 10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 735 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 36 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 3400 m/s bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 140 J/(kg · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 7,61 · 106 A/(V · m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 57 W/(m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,81 V (½ Ta2O5 + 5 H+ + 5 e− → Ta + 2½ H2O) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,5 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


