Molybdän (griech. Μόλυβδος mólybdos „Blei“) ist ein chemisches Element mit dem Elementsymbol Mo und der Ordnungszahl 42. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 5. Periode sowie der 6.Nebengruppe (Gruppe 6) oder Chromgruppe.
Molybdän, das in Lagerstätten in der Regel als Molybdänglanz (Molybdändisulfid) vorkommt, wurde lange Zeit mit Bleiglanz oder auch Graphit verwechselt. 1778 gelang es Carl Wilhelm Scheele, aus Molybdänglanz durch Behandlung mit Salpetersäure das weiße Molybdän(VI)-oxid (auch Molybdäntrioxid) MoO3 (Wasserbleierde) herzustellen. 1782 reduzierte Peter Jacob Hjelm das Oxid mit Kohle zum elementaren Molybdän. Wegen seiner schwierigen Bearbeitbarkeit (reines Molybdän lässt sich plastisch verformen, jedoch schon die Verunreinigung mit einem zehntausendstel Prozent Sauerstoff oder Stickstoff lässt Molybdän stark verspröden) fand Molybdän lange Zeit keine Beachtung. Ende des 19. Jahrhunderts bemerkten Mitarbeiter der französischen Firma Schneider & Co. bei der Herstellung von Panzerrohren die nützlichen Eigenschaften von Molybdän-Legierungen. In den beiden Weltkriegen war die Nachfrage nach dem Metall groß, nach dem Zweiten Weltkrieg fielen die Preise dramatisch. Das einzige westeuropäische Bergwerk wurde bis 1973 in Knaben, Norwegen betrieben.
Vorkommen
Molybdän kommt meistens als Molybdänit (Molybdänglanz, MoS2) mit einer Konzentration von etwa 0,3 % vor. Daneben gibt es noch Wulfenit (Gelbbleierz, PbMoO4) und Powellit Ca(Mo,W)O4. Zur Verhüttung gelangt überwiegend das durch den Kupferbergbau anfallende Koppelprodukt Molybdänit. Das MoS2-Konzentrat, wie es die Minen in Richtung „Röster“ verlässt, enthält ca. 50–60 % Molybdän. Große Vorkommen finden sich in den Vereinigten Staaten,Chile, China, Kanada und Peru. Die Weltproduktion lag 2007 bei 211.000 Tonnen (2006 179.000 t). 2007 erzeugten die USA – als größter Produzent – 62.000 Tonnen, China 60.000 t und Chile 45.000 t.
Molybdän in gediegener, das heißt elementarer Form konnte bisher (Stand: 2011) nur in vier Proben nachgewiesen werden: Auf der Erde in einer Gesteinsprobe vom Vulkan Korjakskaja Sopka auf der russischen Halbinsel Kamtschatka sowie in drei Gesteinsproben des Mondes vom Apollonius-Hochland (Luna 20), dem Mare Crisium (Luna 24) und dem Mare Fecunditatis (Luna 16). Da die Veröffentlichungen der Entdeckungen allerdings ohne Prüfung durch die IMA/CNMNC erfolgte, gilt der Status von Molybdän als Mineral bisher nicht als gesichert, auch wenn es die Mineral-System-Nr. 1.AC.05 (nach der 9. Auflage der Strunz’schen Mineralsystematik) trägt.
Gewinnung und Darstellung
Die Hauptmenge des Molybdäns wird als Nebenprodukt bei der Kupferherstellung gewonnen und nur ca. 30 % direkt aus Molybdänerzen. Alle Erze werden in der Hauptsache zu Ammoniumheptamolybdat umgearbeitet. Dieses wird durch Calcinieren bei ca. 400 °C in Molybdäntrioxid MoO3 überführt. Letzteres wird in zwei Stufen durch Wasserstoff zum reinen Molybdänpulver reduziert. Erste Stufe führt bei 500–600 °C zum metastabilen braunviolettem Molybdändioxid MoO2, die zweite Stufe führt bei ca. 1100 °C zum reinen Metallpulver. Die Verdichtung zum kompakten Metall erfolgt durch das HIP-Verfahren, durch Umschmelzen im Lichtbogenofen unter Argon als Schutzgas oder im Elektronenstrahlofen. Einkristalle werden nach dem Zonenschmelzverfahren hergestellt. Die Molybdän Rückgewinnung aus Schrott beträgt annähernd 100% da keine Oxydationsverluste auftreten.



Eigenschaften
Molybdän ist ein Übergangsmetall der 5. Periode. Das hochfeste, zähe und harte Metall besitzt einen silbrigweißen Glanz. Von allen Elementen der 5. Periode besitzt es den höchstenSchmelzpunkt. Von reduzierenden Säuren (auch Flusssäure) wird es ebenso wie das schwere Homologe Wolfram nicht angegriffen. Deshalb wird Molybdän in großen Mengen zur Herstellung von säurebeständigen Edelstählen und Nickelwerkstoffen eingesetzt. Oxidierende Säuren wie heiße konzentrierte Schwefelsäure, Salpetersäure oder Königswasser führen zu hohen Abtragsraten. Ebenso unbeständig ist Molybdän in oxidierenden Alkalischmelzen.
Verwendung
In kleinen Zusätzen dient es zur Härtung und zur Verhinderung der Anlassversprödung von Stahl. Mehr als zwei Drittel des hergestellten Molybdäns werden zur Erzeugung von Metalllegierungen wie Ferro-Molybdän verbraucht. Wolframverknappung im Ersten Weltkrieg führte zu vermehrtem Einsatz von Molybdän zur Herstellung von hochfesten Werkstoffen. Bis heute ist Molybdän ein Legierungselement zur Steigerung von Festigkeit, Korrosions- und Hitzebeständigkeit. Molybdänhaltige Hochleistungswerkstoffe wie Hastelloy®, Incoloy® oder Nicrofer® haben viele technische Verfahren erst möglich oder ökonomisch sinnvoll gemacht.
Molybdän wird wegen seiner hohen Temperaturbeständigkeit zur Herstellung von Teilen für extreme Anwendungsfälle wie z. B. Luft- und Raumfahrt oder Metallurgietechnik verwendet. In der Ölverarbeitung wird es als Katalysator zur Schwefelentfernung eingesetzt.
Molybdändisulfid ist aufgrund seiner Schichtstruktur ein ideales Schmiermittel, auch bei erhöhten Temperaturen. Es kann als Feststoff, wie Graphit, aber auch suspendiert in herkömmlichen Schmierölen verwendet werden.
Auch in elektronischen Bauteilen ist Molybdän zu finden. In TFTs (Dünnschichttransistoren) dient es als leitende Metallschicht und auch bei Dünnschichtsolarzellen wird es als metallischer Rückleiter verwendet.
Molybdänfolien dienen als gasdichte Stromdurchführung in Quarzglas, u. a. an Halogenglühlampen und Hochdruck-Gasentladungslampen.
Molybdate werden zur Imprägnierung von Stoffen verwendet, um diese schwer entflammbar zu machen.
Molybdän findet auch in der Röntgendiagnostik als Targetmaterial in der Anode Verwendung. Röntgenröhren mit Molybdänanode werden wegen der niedrigeren Energie der Charakteristischen Röntgenstrahlung (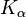 bei 17,4 keV und
bei 17,4 keV und 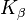 bei 19,6 keV im Vergleich zu 58/59,3 keV bzw. 67,0/67,2/69,1 keV von Wolfram) des Molybdäns v. a. bei der Untersuchung der weiblichen Brust (Mammographie) eingesetzt.
bei 19,6 keV im Vergleich zu 58/59,3 keV bzw. 67,0/67,2/69,1 keV von Wolfram) des Molybdäns v. a. bei der Untersuchung der weiblichen Brust (Mammographie) eingesetzt.
In der Nuklearmedizin wird Spalt-Molybdän in Technetium-99m-Generatoren eingesetzt. Das relativ langlebige 99Mo (HWZ 66 h) zerfällt hierbei innerhalb des RNG in 99mTc (Technetium, HWZ 6 h). Auf diese Weise kann dieses wichtige Technetium-Isotop direkt vor Ort für Untersuchungszwecke gewonnen werden.
Physiologie

Bakterien-Molybdän-Cofaktor bis(Molybdopterin-Guanin-Dinukleotid)-Molybdän
Als Spurenelement ist Molybdän für nahezu alle lebenden Organismen essenziell, da es wesentlicher Bestandteil des aktiven Zentrums einer ganzen Anzahl von Enzymen wie der Nitrogenase, Nitratreduktase oder Sulfitoxidase ist. Lebewesen nutzen molybdänhaltige Enzyme u. a. zur Purinzersetzung und Harnsäurebildung. Die bioverfügbare, d. h. die von Organismen aufgenommene Form von Molybdän ist das Molybdat-Ion MoO42−. Dieses wird in mehreren Schritten als Molybdän-Cofaktoren in die entsprechenden Enzyme eingebaut. Dort kann das Mo-Atom zwischen den Koordinationszahlen +IV, +V und +VI wechseln, und so Ein-Elektronen-Redoxreaktionen katalysieren.
Molybdän ist für Pflanzen essenziell. Durch Molybdänmangel kann ein Boden unfruchtbar sein, was erklärt, warum eine Düngung mit Ammoniumheptamolybdat den Ertrag auf solchen Böden steigert. In Pflanzen und Tieren beträgt die Molybdänkonzentration einige ppm. Molybdän ist ein sehr wichtiges Spurenelement, vor allem für Leguminosen. Die mit den Leguminosen in Symbiose lebenden Bakterien (Knöllchenbakterien) sind in der Lage, mit einem molybdänhaltigen Enzym (Nitrogenase) Luftstickstoff zu binden. Sie benötigen Molybdän für zwei Prozesse: Fixierung von molekularem Stickstoff und Nitratreduktion.
Auch für die menschliche Ernährung ist Molybdän essenziell. Der Schätzwert der DGE für Jugendliche und Erwachsene geht von 50–100 µg Molybdän als angemessene Tageszufuhr aus. Ein Molybdänmangel kommt nicht vor. Werden hohe Aufnahmen (10–15 mg/Tag) erreicht – zum Beispiel durch molybdänreiche Böden, so treten gichtähnliche Symptome, Gelenkschmerzen und Lebervergrößerungen auf.
Der Molybdän-Cofaktor-Mangel tritt jedoch nur als Erbkrankheit auf; dabei ist eines der Enzyme mutiert, die die Biosynthese der Molybdän-Cofaktoren katalysieren.
Sicherheitshinweise
Molybdänstaub und -verbindungen wie Molybdän(VI)-oxid und wasserlösliche Molybdate weisen eine leichte Toxizität auf, wenn sie inhaliert oder oral eingenommen werden.
Tests lassen vermuten, dass Molybdän im Gegensatz zu vielen anderen Schwermetallen relativ wenig toxisch wirkt. Akute Vergiftungen sind wegen der dazu notwendigen Mengen unwahrscheinlich. Im Bereich von Molybdänbergbau und -herstellung könnten höhere Molybdänexpositionen vorkommen. Bisher sind aber keine Krankheitsfälle bekannt geworden.
Nachweis
Ein qualitativer Nachweis sechswertigen Molybdäns ist über die Bildung von Heteropolysäuren mit Phosphat möglich. Gibt man zu einer schwefelsauren molybdathaltigen Lösung Phosphorsäure, dann fällt kristallines Molybdängelbaus. Bei Zusatz des milden Reduktionsmittels Ascorbinsäure erfolgt starke Blaufärbung (Bildung von Molybdänblau). Bei geringeren Konzentrationen von Molybdat erfolgt keine Fällung, sondern nur Farbänderung der Lösung.
![\mathrm{H_2PO_4^- + 12\ MoO_4^{2-} + 6\ H_3O^+ + 3\ NH_4^+ \longrightarrow (NH_4)_3[P(Mo_3O_{12})_4] (gelb) + 10\ H_2O}](https://upload.wikimedia.org/wikipedia/de/math/5/4/e/54e88a032d7745b68a3b0d7bc5907c31.png)
Diese Reaktionen werden auch zur photometrischen Bestimmung von Molybdat oder Phosphat im Spurenbereich eingesetzt. Molybdän kann alternativ mittels Atomspektrometrie bestimmt werden. In der Polarografie ergibt sechswertiges Molybdän in Schwefelsäure einer Konzentration von 0,5 mol/l zwei Stufen bei −0,29 und −0,84 V (gegen SCE). Diese sind auf Reduktion zum Mo(V) bzw. Mo(III) zurückzuführen.
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name, Symbol,Ordnungszahl | Molybdän, Mo, 42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 6, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | grau metallisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7439-98-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an derErdhülle | 14 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 95,94 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 145 (190) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d5 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 684,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1560 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2618 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 4480 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 10,28 g/cm3 (20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( = 1,2 · 10−4) = 1,2 · 10−4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2896 K (2623 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 4912 K (4639 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 9,38 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 600 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 36 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 6190 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 18,2 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 139 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 3, 4, 5, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,152 V (MoO2 + 4e− + 4 H+ → Mo + 2 H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,16 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


