Indium, In, Ordnungszahl 49
Indium Preis, Vorkommen, Gewinnung und Verwendung
Allgemein
Indium ist ein chemisches Element mit dem Symbol In und der Ordnungszahl 49. Im Periodensystem der Elemente steht es in der 5. Periode und ist das vierte Element der 3. Hauptgruppe (nach neuer Zählung Gruppe 13) oder Borgruppe. Indium ist ein seltenes, silberweißes und weiches Schwermetall. Seine Häufigkeit in der Erdkruste ist vergleichbar der von Silber. Indium ist für den menschlichen Körper nicht essentiell, genauso wenig sindtoxische Effekte bekannt. Das Metall wird heute zum größten Teil zu Indiumzinnoxid verarbeitet, das als transparenter Leiter für Flachbildschirme und Touchscreens eingesetzt wird. Seit der Jahrtausendwende hat die damit verbundene gestiegene Nachfrage zu einem deutlichen Anstieg der Indiumpreise und zu Diskussionen über die Reichweite der Vorkommen geführt.
Indium wurde 1863 von den deutschen Chemikern Ferdinand Reich und Theodor Richter an der Bergakademie Freiberg entdeckt. Sie untersuchten eine in der Umgebung gefundene Sphalerit-Probe nach Thallium. Dabei fanden sie im Absorptionsspektrum anstatt der erwarteten Thallium-Linien eine bisher unbekannte indigoblaue Spektrallinie und damit ein bisher unbekanntes Element. Nach dieser erhielt das neue Element später seinen Namen. Kurze Zeit später konnten sie zunächst Indiumchlorid und -oxid, durch Reduktion von Indiumoxid mit Wasserstoff auch das Metall darstellen. Eine größere Menge Indium wurde erstmals auf der Weltausstellung 1867 in Paris gezeigt.
Nach einer ersten Anwendung ab 1933 als Legierungsbestandteil in Zahngold begann der umfangreiche Einsatz von Indium mit dem Zweiten Weltkrieg. Die Vereinigten Staaten setzten es als Beschichtung in hoch beanspruchten Lagern von Flugzeugen ein. Nach dem Zweiten Weltkrieg wurde Indium vor allem in der Elektronikindustrie, als Lötmaterial und in niedrig schmelzenden Legierungen eingesetzt. Auch die Verwendung in Kontrollstäben von Kernreaktoren wurde mit der zunehmenden Verwendung der Kernenergie wichtig. Dies führte bis 1980 zu einem ersten starken Ansteigen des Indiumpreises. Nach dem Reaktorunfall von Three Mile Islandgingen jedoch sowohl Nachfrage als auch Preis deutlich zurück.
Ab 1987 wurden zwei neue Indiumverbindungen, der Halbleiter Indiumphosphid und das in dünnen Schichten leitende und durchsichtige Indiumzinnoxid entwickelt. Besonders Indiumzinnoxid wurde mit der Entwicklung vonFlüssigkristallbildschirmen technisch interessant. Durch den hohen Bedarf wird seit 1992 der größte Teil des Indiums zu Indiumzinnoxid weiterverarbeitet.
Vorkommen
Indium ist ein seltenes Element, sein Anteil an der kontinentalen Erdkruste beträgt nur 0,05 ppm. Es ist damit von ähnlicher Häufigkeit wie Silber und Quecksilber. In gediegenem Zustand wurde Indium bisher nur in einem Einzelfund im östlichen Sibirien gefunden. Es sind nur wenige Indium-Minerale bekannt. Dies sind vor allem sulfidische Minerale wie Indit FeIn2S4 und Roquésit CuInS2. Diese sind jedoch selten und spielen für die Gewinnung von Indium keine Rolle. Die größten Vorkommen von Indium liegen in Zinkerzen, insbesondere Sphalerit. Die theoretischen Reserven werden auf 16.000 Tonnen geschätzt, wirtschaftlich abbaubar sind davon etwa 11.000 Tonnen. Die größten Vorkommen liegen in Kanada, China und Peru. Indiumhaltige Erze werden aber auch in Australien, Bolivien, Brasilien, Japan, Russland, Südafrika, den USA, Afghanistan und einigen europäischen Ländern gefunden. In Deutschland liegen Vorkommen im Erzgebirge (Freiberg, Marienberg, Geyer) und am Rammelsberg im Harz.
Gewinnung und Darstellung
Indium wird fast ausschließlich als Nebenprodukt bei der Produktion von Zink oder Blei gewonnen. Eine wirtschaftliche Gewinnung ist möglich, wenn sich an bestimmten Stellen des Produktionsprozesses Indium anreichert. Dies sind etwa Flugstäube, die während des Röstens von Zinksulfid entstehen und Rückstände, die bei der Elektrolyse während des nassen Verfahrens der Zinkherstellung zurückbleiben. Diese werden mit Schwefelsäure oder Salzsäure umgesetzt und so in Lösung gebracht. Da die Konzentration an Indium in der Säure zu gering ist, muss sie angereichert werden. Dies geschieht etwa durch Extraktion mit Tributylphosphat oder Fällung als Indiumphosphat.
Die eigentliche Indiumgewinnung erfolgt elektrolytisch. Dazu wird eine Lösung von Indium(III)-chlorid in Salzsäure verwendet. Dieses wird mit Hilfe von Quecksilberelektroden zu elementarem Indium umgesetzt. Bei der Elektrolyse ist darauf zu achten, dass die Lösung kein Thallium mehr enthält, da die Standardpotentiale der beiden Elemente sehr ähnlich sind.

Durch geeignete Verfahren wie Zonenschmelzverfahren oder mehrmalige Elektrolyse von Indium(I)-chlorid-Salzschmelzen kann das Rohprodukt weiter gereinigt werden und so über 99,99 % reines Indium gewonnen werden.
Produktion
Die Primärproduktion (Minenproduktion) von Indium lag im Jahr 2006 zwischen 500 und 580 Tonnen. Auf Grund der geringen natürlichen Vorräte von 11.000 Tonnen bei gleichzeitig hoher Nachfrage zählt Indium zu den knappsten Rohstoffen auf der Erde. Im Jahr 2008 wuchsen insbesondere für China die Angaben zu den natürlichen Indium-Vorräten von 280 auf 8.000 Tonnen, was die statische Reichweite von vormals 6 auf 19 Jahre verlängerte. Die Sekundärproduktion, also das Recycling, übertrifft die Primärproduktion und lag im Jahr 2008 bei 800 Tonnen.
Die Indiumproduktion in China findet erst seit kurzer Zeit verstärkt statt. Im Jahr 1994 lag die produzierte Menge noch bei 10 Tonnen. Seitdem vergrößerte sich der Anteil Chinas an der Weltproduktion auf 60 % im Jahr 2005. Die Produktion in anderen Ländern wie Japan, Kanada oder Frankreich konnte nur in geringem Umfang gesteigert werden oder verringerte sich durch Erschöpfung der Lagerstätten. So wurde 2006 die japanische Toyoha-Mine geschlossen und damit die dortige Produktion deutlich verringert.
Da die Nachfrage nach Indium stärker als die Produktion gestiegen ist, ergab sich ein starker Anstieg des Indiumpreises von 97 Dollar 2002 auf 827 Dollar pro Kilogramm im Jahr 2005. Recycling von Indium erfolgt vor allen durch Wiederverwertung von Rückständen aus dem Sputtern. Das einzige Land, in dem derzeit in größeren Mengen Indium wiedergewonnen wird, ist Japan.
Bei weiter steigender Nachfrage und dem damit einhergehenden hohen Preis wird das Recycling auch von Stoffen mit nur geringen Indiummengen rentabel. Ebenso ist es nun wirtschaftlich sinnvoll, auch Erze mit geringeren Indiumgehalten auszubeuten. Dadurch wird es wahrscheinlich möglich sein, das Versiegen der Ressourcen hinauszuzögern.
Indium kann zwar in den meisten Anwendungen durch andere Stoffe ersetzt werden, dabei verschlechtern sich jedoch häufig die Eigenschaften des Produktes oder die Wirtschaftlichkeit der Produktion. So kann etwa Indiumphosphid durch Galliumarsenid ersetzt werden und auch für Indiumzinnoxid sind einige – wenn auch qualitativ schlechtere – Ersatzstoffe möglich.
Eigenschaften
Physikalische Eigenschaften
| Kristallsystem | tetragonal |
| Raumgruppe |  |
| Gitterparameter
(Elementarzelle) |
a = (b) = 325 pm
c = 495 pm |
| Zahl (Z) der
Formeleinheiten |
Z = 2 |

Elementarzelle von Indium mit Koordinationsumgebung des zentralen Indiumatoms

Koordinationspolyeder eines Indiumatoms aus 4 + 8 = 12 Nachbaratomen in der Form eines verzerrten Kuboktaeders
Indium ist ein silbrig-weißes Metall mit einem niedrigen Schmelzpunkt von 156,5985 °C. Einen niedrigeren Schmelzpunkt besitzen unter den Metallen nur Quecksilber, Gallium und die meisten Alkalimetalle. Über einen sehr großen Bereich von fast 2000 K ist das Metall flüssig. Flüssiges Indium hinterlässt auf Glas dauerhaft einen dünnen Film (Benetzung). Die gleiche Eigenschaft besitzt das ähnliche Gallium.
Das Metall besitzt eine hohe Duktilität und sehr geringe Härte (Mohs-Härte: 1,2). Es ist daher möglich, Indium wie Natrium mit dem Messer zu schneiden. Gleichzeitig hinterlässt es auf Papier einen sichtbaren Strich. Unterhalb einer Sprungtemperatur von 3,41 Kelvin ist Indium supraleitend. Eine Besonderheit des Indiums, die es mit dem Zinn gemeinsam hat, sind die charakteristischen Geräusche, die beim Verbiegen von Indium zu hören sind („Zinngeschrei“).
Von Indium ist bei Normalbedingungen nur eine kristalline Modifikation bekannt, die im tetragonalen Kristallsystem in der Raumgruppe  und damit in einem tetragonal-innenzentrierten Gitter mit den Gitterparametern a = 325 pm und c = 495 pm sowie zwei Formeleinheiten in der Elementarzelle kristallisiert.
und damit in einem tetragonal-innenzentrierten Gitter mit den Gitterparametern a = 325 pm und c = 495 pm sowie zwei Formeleinheiten in der Elementarzelle kristallisiert.
Ein Indiumatom wird in der Kristallstruktur von zwölf weiteren Atomen umgeben, wobei vier aus den benachbarten Elementarzellen stammen und einen geringeren Abstand (325 pm; rote Bindungen) als die acht auf den Ecken der Elementarzelle befindlichen Atome aufweisen (337 pm; grüne Bindungen). Als Koordinationspolyeder ergibt sich durch die Koordinationszahl 4 + 8 = 12 ein verzerrtesKuboktaeder. Die Kristallstruktur kann daher als eine tetragonal verzerrte, kubisch-dichteste Kugelpackung beschrieben werden.
In Hochdruckexperimenten wurde eine weitere Modifikation entdeckt, die oberhalb von 45 GPa stabil ist und im orthorhombischen Kristallsystem in der Raumgruppe Fmmm kristallisiert.
Chemische Eigenschaften
Die chemischen Eigenschaften des Indium ähneln denen der Gruppennachbarn Gallium und Thallium. So ist Indium wie die beiden anderen Elemente ein unedles Element, das bei hohen Temperaturen mit vielen Nichtmetallen reagieren kann. An der Luft ist es bei Raumtemperatur stabil, da sich wie bei Aluminium eine dichte Oxidschicht bildet, die das Material durch Passivierung vor weiterer Oxidation schützt. Erst bei hohen Temperaturen findet die Reaktion zu Indium(III)-oxidstatt.
Während Indium von Mineralsäuren wie Salpetersäure oder Schwefelsäure angegriffen wird, ist es nicht löslich in heißem Wasser, Basen und den meisten organischen Säuren. Auch Salzwasser greift Indium nicht an. Indium ist bei Raumtemperatur das in Quecksilber am besten lösliche Metall.
Isotope
Von Indium sind 38 verschiedene Isotope und weitere 45 Kernisomere von 97In bis 135In bekannt. In der Natur kommen davon nur zwei Isotope vor, 113In (64 Neutronen) mit 4,29 % und 115In (66 Neutronen) mit 95,71 % Anteil an der natürlichen Isotopenverteilung. Das häufige Isotop 115In ist schwach radioaktiv, es ist ein Betastrahler mit einer Halbwertszeit von 4,41 · 1014 Jahren. Beide natürlichen Isotope können mit Hilfe der NMR-Spektroskopie nachgewiesen werden. Die stabilsten künstlichen Isotope 111In und 114mIn haben Halbwertszeiten von einigen Tagen, 113mIn nur etwa eineinhalb Stunden. 111In und 113mIn werden nuklearmedizinisch verwendet.
Verwendung
Metall

Indiumdraht wird in Indiumdichtungenverwendet.
Indium ist vielseitig verwendbar, sein Einsatz ist jedoch durch die Seltenheit und den hohen Preis beschränkt. Der größte Teil des produzierten Indiums wird nicht als Metall eingesetzt, sondern zu einer Reihe von Verbindungen weiterverarbeitet. Allein für die Produktion von Indiumzinnoxid wurden im Jahr 2000 65 % der Gesamtproduktion an Indium verwendet. Auch andere Verbindungen, wie Indiumphosphid und Indiumarsenid werden aus dem produzierten Indium gewonnen. Genaueres über die Verwendung von Indiumverbindungen findet sich im Abschnitt Verbindungen.
Metallische Werkstücke können durch galvanisch abgeschiedenene Indiumüberzüge geschützt werden. So beschichtete Werkstoffe etwa aus Stahl, Blei oder Cadmium sind danach beständiger gegen Korrosion durch organische Säuren oderSalzlösungen und vor allem Abrieb. Indiumschutzschichten wurden früher oft für Gleitlager in Automobilen oder Flugzeugen verwendet. Seit dem deutlichen Anstieg des Indiumpreises ist dies jedoch nicht mehr wirtschaftlich. Mit Indium beschichtete Flächen besitzen einen hohen und gleichmäßigen Reflexionsgrad über alle Farben hinweg und können daher als Spiegel verwendet werden.
Der Schmelzpunkt von Indium liegt relativ niedrig und ist sehr genau bestimmbar. Aus diesem Grund ist er einer der Fixpunkte bei der Aufstellung der Temperaturskala. Diese Eigenschaft wird auch für die Kalibrierung in der Dynamischen Differenzkalorimetrie (DSC) genutzt.
Wegen des hohen Einfangquerschnittes sowohl für langsame als auch für schnelle Neutronen ist Indium ein geeignetes Material für Steuerstäbe in Kernreaktoren. Auch als Neutronendetektoren können Indiumfolien verwendet werden. Indium ist gasdicht und auch bei tiefen Temperaturen leicht zu verformen und wird daher in sogenannten Indiumdichtungen in Kryostaten eingesetzt.
Auch als Lot für viele Materialien spielt Indium auf Grund einiger spezieller Eigenschaften eine Rolle. So verformt es sich beim Abkühlen nur in geringem Maß. Dies ist vor allem beim Löten von Halbleitern für Transistoren wichtig. Ebenso spielt eine Rolle, dass Indium in der Lage ist, auch nichtmetallische Stoffe wie Glas und Keramik zu verlöten.
Mit „Indiumpillen“ wurden Germaniumplättchen beiderseits anlegiert, um erste Transistoren herzustellen.
Legierungen
Indium kann mit vielen Metallen legiert werden. Viele dieser Legierungen, vor allem mit den Metallen Bismut, Zinn, Cadmium und Blei, besitzen einen niedrigen Schmelzpunkt von 50 bis 100 °C. Dadurch ergeben sich Anwendungsmöglichkeiten beispielsweise in Sprinkleranlagen, Thermostaten und Sicherungen. Da das ebenfalls verwendbare Blei giftig ist, dient Indium als ungefährlicher Ersatzstoff. Der Zweck dieser Legierungen liegt darin, dass sie bei zu hohen Umgebungstemperaturen, die durch Feuer oder hohe Stromstärken verursacht werden, schmelzen. Durch das Schmelzen wird dann der Stromkreis unterbrochen oder die Sprinkleranlage ausgelöst. Indium-Gallium-Legierungen besitzen häufig noch niedrigere Schmelzpunkte und sind in Hochtemperaturthermometern enthalten. Eine spezielle Gallium-Indium-Zinn-Legierung ist Galinstan. Diese ist bei Raumtemperatur flüssig und dient als ungefährlicher Ersatzstoff für Quecksilber oder Natrium-Kalium-Legierungen.
Es gibt noch einige weitere indiumhaltige Legierungen, die in unterschiedlichen Gebieten eingesetzt werden. So wird Indium mit Kupfer, Mangan und Magnesium als Legierungsbestandteil von magnetischen Werkstoffen verwendet. Gelegentlich wird Indium (maximal 5 %) mit Silber, Zinn, Kupfer, Quecksilber und Zink als Beimischung in Amalgamfüllungen benutzt. In der Speicherschicht einer CD-RW ist unter anderem Indium enthalten.
Nachweis
Ein möglicher chemischer Nachweis ist das Ausfällen von Indiumionen mit Hilfe von 8-Hydroxychinolin aus essigsaurer Lösung. Normalerweise wird Indium nicht auf chemische Weise nachgewiesen, sondern über geeignete spektroskopische Verfahren. Leicht ist Indium über die charakteristischen Spektrallinien bei 451,14 nm und 410,18 nm nachzuweisen. Da diese im blauen Spektralbereich liegen, ergibt sich die typische blaue Flammenfärbung. Für eine genauere quantitative Bestimmung bieten sich die Röntgenfluoreszenzanalyse und dieMassenspektrometrie als Untersuchungsmethode an.
Toxizität und Sicherheit
Während von Indiummetall keine toxischen Effekte bekannt sind, zeigte es sich jedoch, dass Indiumionen im Tierversuch mit Ratten und Kaninchen embryonentoxische und teratogene Effekte besitzen. Bei einer Einmalgabe von 0,4 mg*kg-1 InCl3 an trächtigen Ratten konntenMissbildungen wie beispielsweise Gaumenspalten und Oligodaktylie beobachtet werden. Diese Erscheinungen waren gehäuft festzustellen, wenn das Indium am 10. Schwangerschaftstag appliziert wurde. Bei Mäusen waren dagegen keine Missbildungen zu beobachten. Bei Indiumnitrat wurde eine Toxizität für Wasserorganismen (aquatische Toxizität) festgestellt.
Kompaktes Indiummetall ist nicht brennbar. Im feinverteilten Zustand als Pulver oder Staub ist es dagegen wie viele Metalle leichtentzündlich und brennbar. Brennendes Indium darf wegen der Explosionsgefahr durch entstehenden Wasserstoff nicht mit Wasser gelöscht werden, sondern muss mit Metallbrandlöschern (Klasse D) gelöscht werden.
Verbindungen
Indium bildet eine Reihe von Verbindungen. In ihnen hat das Metall meist die Oxidationsstufe +III. Die Stufe +I ist seltener und instabiler. Die Oxidationsstufe +II existiert nicht, Verbindungen, in denen formal zweiwertiges Indium vorkommt, sind in Wirklichkeit gemischte Verbindungen aus ein- und dreiwertigem Indium.
Indiumoxide
Indium(III)-oxid ist ein gelbes, stabiles Salz. Reines Indium(III)-oxid wird wenig verwendet, in der Technik wird der größte Teil zu Indiumzinnoxid weiterverarbeitet. Es handelt sich hierbei um Indium(III)-oxid, das mit einer geringen Menge Zinn(IV)-oxid dotiert ist. Dadurch wird die Verbindung zu einem transparenten und leitfähigem Oxid (TCO-Material). Diese Kombination von Eigenschaften, die nur wenige weitere Materialien besitzen, bedingt eine breite Anwendung. Insbesondere als Stromleiter in Flüssigkristallbildschirmen (LCD), organischen Leuchtdioden(OLED), Touchscreens und Solarzellen wird Indiumzinnoxid verwendet. In weiteren Anwendungen wie beheizbaren Autoscheiben und Solarzellen konnte das teure Indiumzinnoxid durch billigeres aluminiumdotiertes Zinkoxid ersetzt werden.
Verbindungshalbleiter
Viele Indiumverbindungen sind Verbindungshalbleiter mit charakteristischen Bandlücken. Dies betrifft insbesondere Verbindungen mit Elementen der 15. und 16. Hauptgruppe, wie Phosphor, Arsen oder Schwefel. Diejenigen mit Elementen der 15. Hauptgruppe werden zu den III-V-Verbindungshalbleitern gezählt, diejenigen mit Chalkogenen zu den III-VI-Verbindungshalbleitern. Die Zahl richtet sich jeweils nach der Anzahl an Valenzelektronen in den beiden Verbindungsbestandteilen. Indiumnitrid, Indiumphosphid, Indiumarsenid und Indiumantimonid haben unterschiedliche Anwendungen in verschiedenen Dioden, wie Leuchtdioden (LED), Fotodioden oder Laserdioden. Die genaue Anwendung hängt von der benötigten Bandlücke ab. Indium(III)-sulfid (In2S3) ist ein III-VI-Halbleiter mit einer Bandlücke von 2 eV, der anstelle von Cadmiumsulfidin Solarzellen verwendet wird. Einige dieser Verbindungen – vor allem Indiumphosphid und Indiumarsenid – spielen eine Rolle in der Nanotechnologie. Indiumphosphid-Nanodrähte besitzen eine stark anisotrope Photolumineszenz und können eventuell in hochempfindlichen Photodetektoren oder optischen Schaltern eingesetzt werden.
Neben den einfachen Verbindungshalbleitern gibt es auch halbleitende Verbindungen, die mehr als ein Metall enthalten. Ein Beispiel ist Indiumgalliumarsenid (InxGa1-xAs) ein ternärer Halbleiter mit einer im Vergleich zu Galliumarsenid verringerten Bandlücke. Kupferindiumdiselenid(CuInSe2) besitzt einen hohen Absorptionsgrad für Licht und wird daher in Dünnschichtsolarzellen eingesetzt (CIGS-Solarzelle).
Weitere Indiumverbindungen
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Indium eine Reihe von Verbindungen. Sie sind Lewis-Säuren und bilden mit geeigneten Donoren Komplexe. Ein wichtiges Indiumhalogenid ist Indium(III)-chlorid. Dieses wird unter anderem als Katalysator für die Reduktion organischer Verbindungen eingesetzt.
Es existieren auch organische Indiumverbindungen mit den allgemeinen Formeln InR3 und InR. Sie sind wie viele metallorganische Verbindungen empfindlich gegen Sauerstoff und Wasser. Indiumorganische Verbindungen werden als Dotierungsreagenz bei der Produktion von Halbleitern genutzt.
| Allgemein | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name, Symbol,Ordnungszahl | Indium, In, 49 | |||||||||||||||||||||||||||||||||
| Serie | Metalle | |||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 13, 5, p | |||||||||||||||||||||||||||||||||
| Aussehen | silbrig glänzend grau | |||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-74-6 | |||||||||||||||||||||||||||||||||
| Massenanteil an derErdhülle | 0,1 ppm | |||||||||||||||||||||||||||||||||
| Atomar | ||||||||||||||||||||||||||||||||||
| Atommasse | 114,818 u | |||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 155 (156) pm | |||||||||||||||||||||||||||||||||
| Kovalenter Radius | 144 pm | |||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 193 pm | |||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d105s25p1 | |||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 558,3 kJ/mol | |||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1820,7 kJ/mol | |||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2704 kJ/mol | |||||||||||||||||||||||||||||||||
| Physikalisch | ||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||
| Kristallstruktur | tetragonal | |||||||||||||||||||||||||||||||||
| Dichte | 7,31 g/cm3 | |||||||||||||||||||||||||||||||||
| Mohshärte | 1,2 | |||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch ( = −5,1 · 10−5) = −5,1 · 10−5) |
|||||||||||||||||||||||||||||||||
| Schmelzpunkt | 429,7485[4] K (156,5985 °C) | |||||||||||||||||||||||||||||||||
| Siedepunkt | 2345 K (2072 °C) | |||||||||||||||||||||||||||||||||
| Molares Volumen | 15,76 · 10−6 m3/mol | |||||||||||||||||||||||||||||||||
| Verdampfungswärme | 231,8 kJ/mol | |||||||||||||||||||||||||||||||||
| Schmelzwärme | 3,26 kJ/mol | |||||||||||||||||||||||||||||||||
| Dampfdruck | 1 Pa bei 1196 K | |||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 1215 m/s bei 293,15 K | |||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 233 J/(kg · K) | |||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 12,5 · 106 A/(V · m) | |||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 81,6 W/(m · K) | |||||||||||||||||||||||||||||||||
| Chemisch | ||||||||||||||||||||||||||||||||||
| Oxidationszustände | 3, 1 | |||||||||||||||||||||||||||||||||
| Normalpotential | −0,343 V (In3+ + 3e− → In) | |||||||||||||||||||||||||||||||||
| Elektronegativität | 1,78 (Pauling-Skala) | |||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
Indium Preis
Indium Preise -> Preise Strategische Metalle
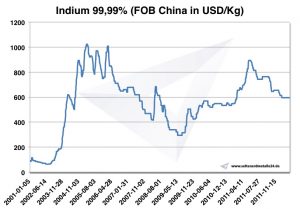
Chart Indium 2001-2011



