Chrom, Cr, Ordnungszahl 24
Chrom – Chrom Gewinnung, Verwendung, Preise
Allgemeines
Chrom (altgr. χρῶμα chrṓma ,Farbe‘) ist ein chemisches Element mit dem Elementsymbol Cr und der Ordnungszahl 24. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 6. Nebengruppe (Gruppe 6) oder Chromgruppe. Die Verbindungen von Chrom haben viele verschiedene Farben und werden oft als Pigmente in Farben und Lacken verwendet.
Gewinnung
Das geförderte Chromiterz wird vom tauben Gestein befreit. Im zweiten Schritt erfolgt ein oxidierender Aufschluss bei ca. 1200 °C zum Chromat:
Das Natriumchromat wird mit heißem Wasser extrahiert und mit Schwefelsäure ins Dichromat überführt:
Das Natriumdichromat kristallisiert beim Abkühlen als Dihydrat aus der Lösung. Durch eine nachfolgende Reduktion mit Kohle erhält man Chrom(III)-oxid:
Im Anschluss erfolgt die aluminothermische Reduktion des Chrom(III)-oxids zu Chrom:
Chrom kann nicht durch Reduktion mit Kohle aus den oxidischen Erzen gewonnen werden, da hierbei Chromcarbid entsteht. Reineres Chrom wird durch elektrolytische Abscheidung des Cr3+-Ions aus schwefelsaurer Lösung dargestellt. Entsprechende Lösungen werden durch Auflösen von Chrom(III)-oxid oder Ferrochrom in Schwefelsäure hergestellt. Ferrochrom als Ausgangsstoff erfordert allerdings eine vorherige Abtrennung des Eisens.
Extrem reines Chrom wird durch weitere Reinigungsschritte nach dem van-Arkel-de-Boer-Verfahren erzeugt.
Ferrochrom wird durch Reduktion von Chromit im Lichtbogenofen bei 2800 °C erzeugt.
Eigenschaften
Chrom ist ein silberweißes, korrosions- und anlaufbeständiges hartes Metall, das im Urzustand zäh, form- und schmiedbar ist. Es ist antiferromagnetisch mit einer Néel-Temperatur von 475 K.[11] Chrom löst sich in Salzsäure und Schwefelsäure nach einiger Zeit unter Wasserstoffentwicklung auf, wenn die schützende Oxidschicht weg ist. HäufigeOxidationsstufen des Chroms sind +2, +3 und +6, wobei +3 die beständigste ist.
Cr(II) ist mit d4-Konfiguration instabil. Es gibt wohl kaum ein Reduktionsmittel, das so schnell Sauerstoff aus der Luft aufnimmt wie Cr(II). Aber auch ohne Luftzutritt sind Cr2+-Lösungen nur dann kurze Zeit stabil, wenn sie aus reinstem Chrom (z. B. Elektrolytchrom) gewonnen werden.
Cr3+ ist die stabilste Form. Dies wird durch die Kristallfeldtheorie erklärt, nach der die d3 Konfiguration durch eine halbgefüllte Unterschale stabilisiert ist.
Cr(VI) als Chromat (CrO42−) bzw. Dichromat (Cr2O72−) wird als starkes Oxidationsmittel eingesetzt. Es ist giftig und karzinogen. In wässrigen Lösungen liegt zwischen den beiden Ionen ein chemisches Gleichgewicht vor, das pH-abhängig ist. Säuert man eine verdünnte gelbe Chromat-Lösung an, gibt man also H+-Ionen dazu, so verschiebt sich nach LeChatelier das Gleichgewicht in Richtung des Dichromates, die Lösung färbt sich orange.

- Sicherheitshinweise und biologische Bedeutung
Die Rolle von Cr(III) (Cr3+-Ionen) im menschlichen Körper wird zur Zeit kontrovers diskutiert. Es gibt Hinweise darauf, dass Cr(III) eine Bedeutung im Kohlenhydrat- und Fettstoffwechsel von Säugetieren haben könnte. Diesen Hinweisen wird zur Zeit nachgegangen. Frühere Hinweise, dass das beliebte Nahrungsergänzungsmittel Cr(III)-picolinateinen günstigen Einfluss auf den Körperaufbau hat, konnten in späteren Studien nicht bestätigt werden. In einer Studie mit Hamsterzellen konnte gezeigt werden, dass Cr(III)-picolinat mutagen ist und Krebs auslösen kann.
Die aktuell zur Verfügung stehenden Daten weisen darauf hin, dass es extrem unwahrscheinlich ist, eine Chromunterversorgung zu erleiden. Einen toxischen Effekt lösen auch höhere Dosen Cr(III) nur schwer aus, da dasLöslichkeitsprodukt von Cr(III)-hydroxid extrem niedrig ist (6,7 · 10−31). Es wird deshalb im menschlichen Darm vermutlich nur sehr schwer aufgenommen. In den USA wurde die empfohlene Aufnahmemenge Cr(III) von 50–200 µg/Tag auf 35 µg/Tag bei erwachsenen Männern und auf 25 µg/Tag bei erwachsenen Frauen heruntergesetzt.
Cr(VI)-Verbindungen sind äußerst giftig. Sie sind mutagen und schädigen die DNS. Sie gelangen über die Atemwege in den Körper und schädigen das Lungengewebe. Menschen, die chronisch solchen Verbindungen ausgesetzt sind, haben ein erhöhtes Risiko für Lungenkrebs. Die giftige Wirkung steigt dabei mit der Unlöslichkeit des Salzes. Die RoHS-Richtlinie schränkt die Verwendung von Cr(VI)-Verbindungen in Europa stark ein.
Verwendung
Chrom und Chromverbindungen werden für die verschiedensten Anwendungen eingesetzt, in denen seine Beständigkeit genutzt wird.:
- Hartverchromung: galvanisches Aufbringen einer bis zu 1 mm dicken Verschleißschutzschicht direkt auf Stahl, Gusseisen, Kupfer. Auch Aluminium kann nach dem Aufbringen einer Zwischenschicht verchromt werden (Hartverchromte Aluminiumzylinder im Motorenbau).
- Dekorverchromung: galvanisches Aufbringen einer < 1 μm dicken Cr-Schicht als Dekor mit einer korrosionsschützenden Zwischenschicht aus Nickel oder Nickel-Kupfer. Sehr oft werden auch Kunststoffteile verchromt. Ein Ersatz für die Dekorverchromung ist das Achrolyte-Verfahren.
- Passivierung von galvanischen Zinkschichten (Chromatierung)
- Legierungselement: in korrosions- und hitzebeständigen nichtrostenden Stählen und NE-Legierungen
- Katalysator: um chemische Reaktionen zu ermöglichen oder zu beschleunigen
- Chromgerbung: das wichtigste Verfahren zur Herstellung von Leder
Verbindungen
- Chromoxidgrün
- Chrom(III)-oxid Cr2O3, wird als Emaillefarbe und zum Glasfärben (grüne Flaschen) verwendet (auch Kölner Brückengrün). Dieses ist nicht mit dem giftigen Chromgrün zu verwechseln.
- Chromgelb
- Blei(II)-chromat PbCrO4, diente früher als brillant gelbes Farbpigment („Postgelb“). Auf Grund seiner Toxizität wird es heute fast vollständig durch organische Farbpigmente ersetzt. In der Analytik wird es zur iodometrischen Bestimmung von Blei genutzt.
Das Chromgelb, das als Künstlerfarbe Anwendung findet, ist je nach Herstellung ein Bleisulfat/Bleichromat (etwa 2 PbSO4 · PbCrO4). Das Pigment wurde 1809 von Louis-Nicolas Vauquelin entdeckt und seit 1820 kommerziell in Deutschland hergestellt. Chromgelb hat ein hohes Deckvermögen, seine Lichtstabilität hängt von dem Gelbton ab. Chromgelb wird kaum in der Ölmalerei verwendet. Vincent van Gogh allerdings verwendete Chromgelb u. a. in den berühmten Sonnenblumenbildern, die in Öl auf Leinwand ausgeführt sind. Diese leiden jedoch heute teilweise unter einer Verfärbung der Gelbtöne.
Der Kunsttechnologe Prof. Christoph Krekel von der Kunstakademie Stuttgart zu der Verwendung des Pigments Chromgelb: „Die Maler haben sich auf das Chromgelb gestürzt, weil es ein sehr brillantes Gelb ist – es hat eine große Farbintensität, das heißt, man konnte mit Hilfe dieses neuen gelben Farbtons eine sehr viel leuchtstärkere Malerei herstellen“.
Chromgelb ist auch eine wichtige Farbe bei der Fälschungsanalyse „alter“ Gemälde.
- Chromdioxid
- Chrom(IV)-oxid CrO2, ist ein schwarzes ferromagnetisches Pulver zur Herstellung von Magnetbändern mit einem besseren Signal-Rausch-Verhältnis als konventionelle Eisenoxid-Magnetbänder, da Chromdioxid eine höhere Koerzitivität besitzt.
- Chromsäure
- mit der hypothetischen Struktur H2CrO4 existiert nur in verdünnter wässriger Lösung. Sie ist sehr giftig. Als Anion existiert sie in einigen Chromaten und Dichromaten.
Das Anhydrid der Chromsäure, das sehr giftige Chrom(VI)-oxid CrO3, wird als Chromtrioxid bezeichnet.
Das orangefarbene, sehr giftige Kaliumdichromat K2Cr2O7 ist ein kräftiges Oxidationsmittel: In schwefelsaurer Lösung werden primäre Alkohole leicht in die betreffenden Aldehyde umgewandelt, was man zum halbquantitativen Nachweis von Alkohol in der Atemluft nutzen kann. Im Laborbereich wurde es in Form von Chromschwefelsäure zur Reinigung von Glasgeräten verwendet. Beim Kontakt mit Chloridionen wird jedoch das flüchtige, krebserregende Chromylchlorid CrO2Cl2 gebildet (Abzug!). Kaliumdichromat wird außerdem als Titrationsmittel verwendet sowie als Fixiermittel in industriellen Färbebädern. Kaliumdichromat und das ebenfalls sehr giftige Ammoniumdichromat (NH4)2Cr2O7 sind die lichtempfindliche Substanz in Chromgelatineschichten der frühenFotografie (siehe Edeldruckverfahren).
- Chromit
- (Chromeisenstein; siehe oben) FeCr2O4 wird zur Herstellung von Formen für das Brennen von Ziegelsteinen verwendet.
Chrom – Preise, Charts und historische Daten
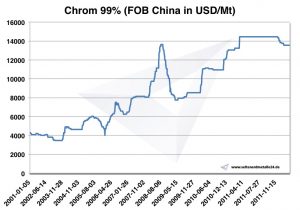
Chart Chrom 2001-2011








 = 3,1 · 10−4)
= 3,1 · 10−4)


