Wolfram, W, Ordnungszahl 74
Wolfram Preis, Vorkommen, Gewinnung und Verwendung
Wolfram [ˈvɔlfram] ist ein chemisches Element mit dem Elementsymbol W und der Ordnungszahl 74. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 6. Nebengruppe (Gruppe 6) oder Chromgruppe. Wolfram ist ein weißglänzendes in reinem Zustand sprödes Schwermetall hoher Dichte. Es besitzt von allen reinen Metallen den höchsten Schmelzpunkt und den zweithöchsten Siedepunkt. Seine bekannteste Verwendung ist daher die Glühwendel in Glühlampen.
Bereits im 16. Jahrhundert beschrieb der Freiberger Mineraloge Georgius Agricola das Vorkommen eines Minerals in sächsischen Zinnerzen, welches die Zinngewinnung durch Verschlackung des Zinnanteils erheblich erschwerte. Der Namensbestandteil „Wolf“ rührt von dieser Eigenschaft, da das Mineral das Zinnerz wie ein Wolf „auffraß“. Ob es sich dabei um Wolframit handelte, ist auch heute noch umstritten, da er von der „Leichtigkeit“ des Minerals sprach. Er nannte das Mineral lupi spuma, was aus dem Lateinischen übersetzt soviel wie „Wolf(s)-Schaum“ bedeutet. Später wurde es Wolfram genannt, von mhd. rām „Ruß, Dreck“, da sich das schwarzgraue Mineral sehr leicht zerreiben lässt und dann an Ruß erinnert. Sein chemisches Symbol W stammt von Wolfram.
Das im Englischen, Italienischen und Französischen gebräuchliche Wort Tungsten leitet sich von Tung Sten (schwedisch für „schwerer Stein“) ab. Damit wurde in Schweden seinerzeit aber nicht Wolfram selbst (schwedisch Volfram), sondern Calciumwolframat bezeichnet. In diesem erkannte 1781 der deutsch-schwedische Chemiker Carl Wilhelm Scheele ein bis dahin unbekanntes Salz. Reines Wolfram wurde erstmals 1783 von den spanischen Brüdern Faustound Juan José Elhuyar (die unter der Leitung Scheeles arbeiteten) durch Reduktion von Wolframtrioxid, welches man aus Wolframit gewinnt, hergestellt.
Vorkommen

Wolfram Metall auch Wolframit genannt
Der Wolframgehalt der Erdkruste liegt etwa bei 0,0001 g/t oder 0,0064 Gewichtsprozent (Clarke-Wert). Das Metall konnte in der Natur bisher nicht gediegen (in reiner Form) nachgewiesen werden. Die „Doklady Akademii Nauk“ in Russland veröffentlichten 1995 einen Bericht zu gediegen Wolfram, ohne dass dieser von der zur IMA gehörenden „Commission on new Minerals, Nomenclature and Classification“ (CNMNC) geprüft wurde. Es sind einige Minerale, vor allem Oxide und Wolframate bekannt. Die wichtigsten Wolframerze sind Wolframit (Mn, Fe)WO4 und Scheelit CaWO4. Daneben gibt es weitere Wolframminerale, wie Stolzit PbWO4 und Tuneptit WO3 · H2O.
Die größten Lagerstätten findet man in China, Peru, den USA, Korea, Bolivien, Kasachstan, Russland, Österreich und Portugal. Auch im Erzgebirge findet man Wolframerze. Die sicheren und wahrscheinlichen Weltvorkommen betragen derzeit 2,9 Mio. Tonnen reines Wolfram.
Das bedeutendste bekannte Vorkommen von Wolfram in Europa befindet sich im Felbertal in den Hohen Tauern (Bundesland Salzburg in Österreich).
Förderung weltweit
2006 betrug die Weltproduktion von reinem Wolfram 73.300 Tonnen. Der mit Abstand größte Produzent an Wolfram ist China. Mehr als 80 % des auf der Welt produzierten Wolframs wird dort hergestellt. Die Staaten mit der größten Förderung von Wolfram (2006):
| Rang | Land | Fördermengen(in Tonnen pro Jahr ) |
|---|---|---|
| 1 | China | 62.000 |
| 2 | Russische Föd. | 4.500 |
| 3 | Kanada | 2.500 |
| 4 | Österreich | 1.350 |
| 5 | Portugal | 900 |
| 6 | Nordkorea | 600 |
| 7 | Bolivien | 530 |
| 8 | andere Länder | 900 |
Förderung in Österreich
In Österreich wurde das Wolframerz Scheelit erstmals schon 1815/16 auf der Goldlagerstätte Schellgaden in der Gemeinde Muhr (Bundesland Salzburg) entdeckt. In der Folge fand man in vielen Klüften der Hohen Tauern schöne, mitunter mehrere Zentimeter große Scheelitkristalle. Diese Funde waren allesamt von keinem praktischen Nutzen. Die große Lagerstätte im Felbertal blieb vorerst unentdeckt.
1950 wurde bekannt, dass in der bereits seit 1927 im Abbau befindlichen Magnesitlagerstätte auf der Wanglalm bei Lanersbach/Tux (Tirol) im hinteren Zillertal Scheelit in größeren Mengen auftrat. Es handelte sich dabei um derben, mit Magnesit und Quarz verwachsenen Scheelit. In den folgenden Jahren wurden jeweils etwa 10.000 Tonnen Erz mit einem Wolframoxidgehalt von durchschnittlich 1,8 % gewonnen, was eine weltweit einmalig hohe Qualität darstellte. Wegen des niedrigen Marktpreises wurde die Wolframgewinnung Ende der 1960er Jahre eingestellt, aber 1971 wiederaufgenommen und bis zur Schließung des Magnesitbergbaues 1976 weitergeführt.
1967 wurde schließlich das bislang größte Scheelitvorkommen Europas im Felbertal entdeckt. Den in Bächen vorhandenen Erzstücken wurde dabei mit Hilfe von UV-Licht nachgespürt (Scheelit fluoresziert). Die schwierigen Explorationsarbeiten im hochalpinen Gelände (höchste Abbaustelle am Brentling in 2100 m Seehöhe) begannen 1971, der vorerst übertägige Bergbau wurde im Felbertal 1976 aufgenommen (ab 1979 auch Untertagebergbau, Übertagebergbau 1986 eingestellt). Von Anfang 1993 bis Mitte 1995 war der Bergbau wegen des niedrigen Marktpreises für Wolfram vorübergehend eingestellt.
Wolframerz aus dem Felbertal wird im nahen Mittersill aufbereitet. Von hier gelangt das Scheelitkonzentrat nach Sankt Martin im Sulmtal (Steiermark). Auf dem Gelände der 1976 geschlossenen Untertage-Braunkohlengrube von Pölfing-Bergla entstand eine Wolframhütte, in der seit 1977 aus Konzentraten aus mehreren Ländern Wolframoxid-, Wolframmetall- und Wolframcarbidpulver hergestellt werden.
Bedeutendste deutsche Verarbeiter sind H.C. Starck und die Longyear GmbH.
Gewinnung und Darstellung
Wolfram kann nicht durch Reduktion mit Kohle aus den oxidischen Erzen gewonnen werden, da hierbei Wolframcarbid entsteht.
Durch Zusatz ammoniakalischer Lösung entsteht ein Komplex namens Ammonium-Parawolframat (APW). Dieser wird abfiltriert und anschließend bei 600 °C in relativ reines Wolframtrioxid überführt. Durch Glühen erhält man Wolfram(VI)-oxid (WO3), das bei 800 °C unter Wasserstoffatmosphäre zu stahlgrauem Wolfram reduziert wird:
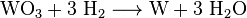
Dabei entsteht graues Wolframpulver, dieses wird meist in Formen verdichtet und elektrisch zu Barren gesintert. Bei Temperaturen über 3400 °C kann in speziellen Elektroöfen mit reduzierender Wasserstoffatmosphäre ein kompaktes Wolframmetall erschmolzen werden (Zonenschmelzverfahren).
Eigenschaften
Physikalische Eigenschaften
Wolfram ist ein weißglänzendes, in reinem Zustand dehnbares Metall hoher Härte, Dichte und Festigkeit. Die Dichte ist fast gleich hoch wie die von Gold, die Brinellhärte beträgt 250 HB, die Zugfestigkeit 550-620 N/mm2 (weich) bis 1920 N/mm2 (hart). Das Metall existiert in einer stabilen kubisch-raumzentrierten α-Modifikation mit einem Netzebenenabstand (=Gitterkonstante) von 316 pm bei Raumtemperatur. Dieser Kristallstrukturtyp wird häufig Wolfram-Typ genannt. Bei einer als metastabile β-Modifikation des Wolframs (verzerrt kubisch-raumzentriert) bezeichneten Substanz handelt es sich hingegen um das wolframreiche Oxid W3O.
Wolfram besitzt nach dem Element Kohlenstoff mit 3422 °C den zweithöchsten Schmelzpunkt aller chemischen Elemente. Der Siedepunkt von 5555 °C wird nur noch von dem seltenen Metall Rhenium mit 5596 °C um 41 K übertroffen.
Das Metall ist ein Supraleiter mit einer Sprungtemperatur von 15 mK.
Chemische Eigenschaften
Wolfram ist ein chemisch sehr widerstandsfähiges Metall, das selbst von Fluorwasserstoffsäure und Königswasser (zumindest bei Zimmertemperatur) kaum angegriffen wird. Es löst sich aber in Gemischen aus Fluss- und Salpetersäure und geschmolzenen Gemischen aus Alkalinitraten und -karbonaten auf.
Isotope
Von Wolfram sind 33 Isotope und 5 Kernisomere bekannt. In der Natur kommen davon 5 Isotope vor 180W, 182W, 183W, 184W und 186W. Das Wolframisotop 184W weist dabei die größte Häufigkeit auf. Alle 5 natürlichen Isotope wurden lange Zeit für stabil gehalten. Erst 2004 gelang dem CRESST Experiment am Laboratori nazionali del Gran Sasso als Nebenergebnis der Suche nach Dunkler Materie der Nachweis, dass das Isotop 180W dem Alphazerfallunterliegt. Die Halbwertszeit beträgt extrem lange 1,8 Trillionen Jahre, daher ist dieser Zerfall in normaler Laborumgebung nicht nachweisbar. Die Radioaktivität dieses natürlichen Isotops ist so gering, dass sie für alle praktischen Zwecke ignoriert werden kann. Die künstlichen radioaktiven Isotope von Wolfram haben dagegen kurze Halbwertszeiten zwischen 0,9 ms bei 185W und 121,2 Tagen bei 181W.
Verwendung
Die wichtigste Anwendung von Wolfram ist wegen seines hohen Schmelzpunktes in der Leuchtmittelindustrie als Glühwendel in Glühlampen und als Elektrode in Gasentladungslampen und in Elektronenröhren.
In Glühlampen macht man sich dabei zu Nutze, dass die elektrische Leitfähigkeit von Wolfram deutlich geringer ist als die der Leitungsmetalle Kupfer und Aluminium. Dadurch heizt sich die dünne Glühwendel aus Wolfram auf, bis sie glüht, während die dickeren Zuleitungen aus den Leitungsmetallen kaum warm werden.
Seine zweite große Bedeutung hat es als Legierungsmetall in der Eisenmetallurgie. Es bildet in Werkzeugstählen Wolframcarbide, welche die Sekundärhärte erhöhen.
Auf Grund seiner hohen Dichte wird es für Ausgleichsgewichte und zur Abschirmung von Strahlung verwendet. Obwohl seine Dichte und damit die Abschirmwirkung wesentlich höher ist als die von Blei, wird es seltener als Blei für diesen Zweck verwendet, da es teurer und schwerer zu verarbeiten ist. Ebenfalls wird wegen der hohen Dichte des Wolframs in einigen Armeen panzerbrechende Munition mit einem Projektilkern aus Wolframcarbid anstelle des billigeren, aber radioaktiven und giftigen abgereicherten Urans verwendet. Im Zweiten Weltkrieg war Wolfram wichtig für den Bau der deutschen Panzergranate 40, welche einen Wolframkern besaß. In Zukunft soll Munition mit Wolframkern vom neuen Schützenpanzer Puma benutzt werden, der den Marder ablösen soll.
Wegen seiner hohen Korrosionsbeständigkeit kann Wolfram auch als Werkstoff für Apparaturen in chemischen Anlagen verwendet werden. Allerdings wird diese Anwendungsform wegen der schlechten Bearbeitbarkeit von Wolfram (Wolfram kann nur mittels Laser- oder Elektronenstrahl geschweißt werden) nur selten angewandt. Das Gleiche gilt auch für eine denkbare Anwendung im Bereich der Medizintechnik.
In der Physiologie, besonders der Neurophysiologie, werden Mikroelektroden aus Wolfram für extrazelluläre Ableitungen verwendet.
Zudem werden Elektroden für Schweißprozesse aus Wolfram hergestellt. Z.B. beim Widerstandsschweißen, insbesondere wenn Werkstoffe wie Kupfer, Bronze oder Messing geschweißt werden sollen. Auch beim universellen WIG (Wolfram-Inert-Gas) Schweißen besteht eine Elektrode aus Wolfram oder einer Legierung davon. Diese Elektroden werden dabei nicht im Schweißprozess abgeschmolzen. Der Lichtbogen brennt dabei als Plasma in einem Schutzgas zwischen der Elektrode und dem Bauteil. Das Füllmaterial wird in Form von Stäben separat zugeführt.
Im Sport kommt Wolfram zur Herstellung hochwertiger Barrels für das Dartspiel zum Einsatz, im Bogensport werden Spitzen für besondere Pfeile daraus hergestellt, und beim Hammerwurf wurden Hammerköpfe zeitweise zur Reduktion des Luftwiderstandes und des Rotationsradius ebenfalls aus Wolfram gefertigt. Außerdem werden Wolframplatten als Zusatzgewichte in der Formel 1 verwendet, um das vorgeschriebene Mindestgewicht von Formel 1-Wagen (inkl. Öl-, Brems- und Kühlflüssigkeit, sowie Fahrer im Rennoverall und mit Helm) von 620 kg (Stand: 2010) zu erreichen. Auch im Segelsport kommt es seit einiger Zeit in den Kielbomben großer Racer zum Einsatz. Dabei wird der Wasserwiderstand durch die größere Dichte gegenüber herkömmlichen Materialien wie Blei oder Gusseisen stark verringert. Ebenso gibt es bereits Schläger im Tennissport, in deren Carbonrahmengeflecht Wolframfasern eingearbeitet wurden. So können ganz gezielt bestimmte Bereiche des Schlägerrahmens zusätzlich stabilisiert werden um die Spielpräzision zu erhöhen.
Beim Fliegenfischen werden Nymphen und Streamer (unter Wasser gefischte Köder) mit durchbohrten und auf den Hakenschenkel geschobenen Wolframperlen beschwert, damit sie schneller und tiefer abtauchen.
Saiten für Musikinstrumente werden zum Teil mit Wolfram umsponnen, um ihr Gewicht zu erhöhen und dadurch die Tonhöhe zu verringern.
Wolfram findet auch in der Röntgendiagnostik als Targetmaterial in der Anode Verwendung. Die 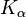 – und
– und 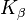 -Linien der Charakteristischen Röntgenstrahlung liegen um 59 keV bzw. 67 keV.
-Linien der Charakteristischen Röntgenstrahlung liegen um 59 keV bzw. 67 keV.
In der Rastertunnelmikroskopie wird Wolfram oft als Material für die Sondenspitze verwendet.
Seit Anfang des 21. Jahrhunderts wird Wolframcarbid, fälschlicherweise als Wolfram bezeichnet, auch zu Schmuck (Tungsten-Schmuck), z. B. Ringen verarbeitet. Dieses ist sehr leicht anhand der Härte und der Dichte feststellbar. WC hat die Mohshärte9,5, Wolfram nur 7,5. Bisher sind alle auf dem Markt befindlichen Schmuckteile aus Wolframcarbid hergestellt.
Physiologie
Wolfram wird als positives Bioelement von anaeroben Bakterien des Typs Eubacterium acidaminophilum verwendet und als Cofaktor in einige Enzyme eingebaut. E. acidaminophilum ist ein Aminosäuren vergärendes Bakterium, welches Wolfram in den Enzymen Formiat-Dehydrogenase und Aldehyd-Dehydrogenase nutzt. In diesen Organismen ersetzt Wolfram das Molybdän, weil es in deren natürlichen Umgebung (Vulkanschlote am Meeresboden) weitaus häufiger vorkommt.
Toxikologie
Nach dem derzeitigen Wissensstand gelten Wolfram und seine Verbindungen als physiologisch unbedenklich. Lungenkrebserkrankungen bei Arbeitern in Hartmetall produzierenden oder verarbeitenden Betrieben werden auf das ebenfalls anwesendeCobalt zurückgeführt.
Im Tiermodell wurde festgestellt, dass die größte Menge an peroral aufgenommenen Wolfram-Verbindungen wieder rasch über den Urin ausgeschieden wird. Ein kleiner Teil des Wolframs geht in das Blutplasma und von dort in die Erythrozyten über. Danach wird es in den Nieren und im Knochensystem abgelagert. Drei Monate nach der Verabreichung wird der größte Anteil des insgesamt nur in sehr kleiner Menge vom Körper aufgenommenen Wolframs in den Knochen gefunden.
2003 wurden in Fallon/Nevada mit 16 seit 1997 an Leukämie erkrankten Kindern und in Sierra Vista/Arizona mit neun ebenfalls an Blutkrebs erkrankten Kindern zwei sogenannte Krebscluster – das ist ein lokales Gebiet mit einer überdurchschnittlich hohen Rate an Krebserkrankungen – identifiziert. In beiden Orten weist das Trinkwasser außergewöhnlich hohe Konzentrationen von Wolfram auf. Im Urin der Bevölkerung wurden deutlich erhöhte Wolframkonzentrationen nachgewiesen. Beide Orte sind für ihre Vorkommen von Wolfram-Erzen bekannt. In den nachfolgenden, etwa ein Jahr dauernden Untersuchungen des Centers for Disease Control (CDC) konnte allerdings kein direkter Zusammenhang zwischen Wolfram und den Leukämie-Erkrankungen festgestellt werden. Wolfram zeige in keinem Testverfahren karzinogene Wirkungen, und in anderen Orten Nevadas mit ähnlich hohen Wolframwerten im Urin der Bevölkerung seien keine Krebscluster feststellbar.
Sicherheitshinweise
Als Pulver oder Staub ist es leicht entzündlich, in kompakter Form nicht brennbar.
Verbindungen
Oxide
Wolfram bildet mehrere Oxide. Zwischen dem Anfangsglied:
- Wolfram(VI)-oxid WO3 – zitronengelb
und dem Endglied:
- Wolfram(IV)-oxid WO2 – braun
gibt es noch folgende intermediäre Oxide:
- W10O29 blauviolett, Homogenitätsbereich WO2,92-WO2,88
- W4O11 rotviolett, Homogenitätsbereich WO2,76-WO2,73
- W18O49, WO2,72
- W20O50, WO2,50
Sonstige Verbindungen
- Natriumwolframat Na2WO4
- Zirkoniumwolframat ZrW2O8 zeigt beim Erwärmen eine Anomalie.
- Wolframbronzen MxWO3; M=Alkali-,Erdalkalimetall,Lanthanoid, ca. 0.3 < x < 0.9 besitzen elektrische Leitfähigkeit und sind intensiv und je nach Metallgehalt unterschiedlich gefärbt.
- Calciumwolframat CaWO4 ist als Mineral unter dem Namen Scheelit bekannt.
- Wolframcarbid WC ist eine extrem harte metallähnliche Verbindung. Daneben gibt es noch Diwolframcarbid W2C.
- Wolframhexafluorid WF6
- Bleiwolframat PbWO4
- Wolframdisulfid WS2 Einsatz als trockenschmiermittel (Ähnlich MoS2)
Verwendung der Verbindungen
Wolframcarbid wird als Neutronenreflektor bei Kernwaffen eingesetzt, um die kritische Masse herabzusetzen. Wolframcarbide (Hartmetall) werden aufgrund ihrer hohen Härte in der Materialbearbeitung verwendet.
Wolframate werden zur Imprägnierung von Stoffen verwendet, um diese schwer entflammbar zu machen.
Wolframhaltige Farben werden in der Malerei sowie in der Keramik- und Porzellanindustrie verwendet.
Bleiwolframat wird als moderner Szintillator in der Teilchenphysik verwendet.
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name, Symbol,Ordnungszahl | Wolfram, W, 74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 6, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gräulich weiß, glänzend | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-33-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an derErdhülle | 64 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 183,84 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (193) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 162 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f145d46s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 770 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1700 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 19,3 g/cm3 (20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 7,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( = 7,8 · 10−5) = 7,8 · 10−5) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 3695 K (3422 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 5828 K (5555 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 9,47 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 824 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 35,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 5174 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 138 J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 18,52 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 170 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 6, 5, 4, 3, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,119 V (WO2 + 4H+ + 4e− → W + 2H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,36 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
GefahrH- und P-SätzeH: 228EUH: keine EUH-SätzeP: 210-240-241-280-370+378 Gefahrstoffkennzeichnung
 |
| Leicht- entzündlich |
| (F) |
PulverR- und S-SätzeR: 11S: 43
Wolfram Preis
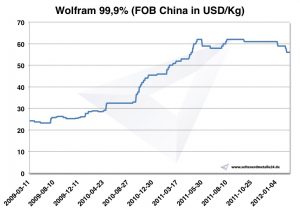
Chart Wolfram 2009-2012
