Gadolinium, Gd, Ordnungszahl 64
Allgemeines
Gadolinium ist ein chemisches Element mit dem Elementsymbol Gd und der Ordnungszahl 64. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der seltenen Erden.
Das erste Element der Yttererden im Periodensystem wurde 1880 spektroskopisch von Jean Charles Galissard de Marignac im Didym und Gadolinit gefunden. 1886 stellte er es als weißes Oxid aus Samarskit her und nannte es Y aus Samarskit. Im gleichen Jahr stellte Paul Emile Lecoq de Boisbaudran ebenfalls Gadoliniumoxid her und nannte das neue Element nach dem Entdecker des Minerals Gadolinit, dem finnischen Chemiker Johan Gadolin, Gadolinium.
Erst 1935 gelang Georges Urbain die Darstellung des Metalls.
Natürlich kommt Gadolinium nur in Verbindungen vor. Technisch bedeutsam sind Monazit und Bastnäsit. Die Gadolinitvorkommen in der Grube Ytterby, nördlich von Stockholm, sind heute erschöpft.
Gewinnung
Nach einer aufwendigen Abtrennung der anderen Gadoliniumbegleiter wird das Oxid mit Fluorwasserstoff zum Gadoliniuimfluorid umgesetzt. Anschließend wird dieses mit Calcium unter Bildung von Calciumfluorid zum metallischen Gadolinium reduziert. Die Abtrennung verbleibender Calciumreste und Verunreinigungen erfolgt in einer zusätzlichen Umschmelzung im Vakuum.
Besonderheiten
Das silbrigweiß bis grauweiß glänzende Metall der seltenen Erden ist duktil und schmiedbar. Bei Temperaturen oberhalb 1508 K wandelt sich die dichteste Kugelpackung in eine kubisch-raumzentrierte Kristallstruktur um. In trockener Luft ist Gadolinium relativ beständig, in feuchter Luft bildet es eine nichtschützende, lose anhaftende und abblätternde Oxidschicht aus. Mit Wasser reagiert es langsam. In verdünnten Säuren löst es sich auf.
Gadolinium hat mit 49.000 barn wegen seines enthaltenen Isotops Gd-157 (mit 254.000 barn) den höchsten Einfangquerschnitt für thermische Neutronen aller bekannten stabilen Elemente (nur das instabile Xe-135 übertrifft Gd-157 etwa um einen Faktor 10). Die hohe Abbrandrate (burn-out-rate) schränkt eine Verwendung als Steuerstab in Kernreaktoren stark ein.
Zusammen mit Dysprosium, Holmium, Erbium und Terbium, die ebenso der Gruppe der Lanthanoiden zugeordnet sind, gehört es zu den einzigen Elementen – ausgenommen Eisen, Cobalt und Nickel – die einen Ferromagnetismus aufweisen. Jedoch muss es dazu erst unter seine ferromagnetische Curie-Temperatur von 292,5 K (19,3 °C) gebracht werden.[6]
Entgegen vielen Literaturangaben ist Gadolinium nicht supraleitfähig. Dies begründet sich auch auf der Erfahrung, dass Verunreinigungen ferromagnetischer Stoffe wie Eisen und Gadolinium die Supraleitfähigkeit anderer Elemente zerstört. Es sind aber keramische Hochtemperatur-Supraleiter des Typs Ba2GdCu3O7-x mit einer Sprungtemperatur zwischen 80–85 K bekannt.
Stäube von metallischem Gadolinium sind feuer- und explosionsgefährlich.
Verwendung
Gadolinium wird zur Herstellung von Gadolinium-Yttrium-Granat für Mikrowellenanwendungen verwendet. Oxysulfide dienen zur Herstellung von grünem Leuchtstoff für nachleuchtende Bildschirme (Radar).
Intravenös injizierte Gadolinium(III)-Verbindungen, wie zum Beispiel Gadopentetat-Dimeglumin, dienen als Kontrastmittel bei Untersuchungen im Kernspintomographen. Dazu werden wegen der hohen Giftigkeit von freien Gadolinium-Ionen Komplexierungsmittel mit hoher Komplexierungskonstante, wie beispielsweise die Chelate DTPA (Diethylentriaminpentaessigsäure) und DOTA (1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure, mit Gd = Gadotersäure), verwendet. Durch die sieben ungepaarten Elektronen in der f-Schale ist Gadolinium stark paramagnetisch. Das Kontrastmittel ermöglicht so den umgebenden Protonen – im wesentlichen Wasser – schneller zu relaxieren. Dies erhöht die Kontrastunterschiede zwischen verschiedenen Geweben in einer MRT-Aufnahme erheblich.
Auch für Untersuchungen am Gehirn können diese Kontrastmittel verwendet werden, da die Gadolinium-Komplexe die Blut-Hirn-Schranke bei gesunden Patienten nicht überwinden und somit eine Blut-Hirn-Schrankenstörung – ein Hinweis auf ein pathologisches Geschehen (z.B. Mangeldurchblutung, Tumor, Entzündung) – sichtbar machen können.
Gadolinium-Gallium-Granat wurde zur Herstellung von Magnetblasenspeichern genutzt. Auch in der Herstellung von wiederbeschreibbaren Compact Discs findet es Anwendung.
Zusätze von 1 % Gadolinium erhöhen die Bearbeitbarkeit und die Hochtemperatur- und Oxidationsbeständigkeit von Eisen- und Chromlegierungen. Entsprechende Gadoliniumeisenkobalt-Legierungen können zur optomagnetischen Datenspeicherung eingesetzt werden.
Gadolinium könnte, da es einen Curie-Punkt nahe der Zimmertemperatur besitzt, in Kühlgeräten, die nach dem Prinzip der adiabatischen Magnetisierung funktionieren, Verwendung finden. Solche Kühlgeräte würden ohne die Ozonschicht schädigende Fluorchlorkohlenwasserstoffe (FCKW) auskommen und besäßen keine dem Verschleiß unterliegenden mechanischen Teile.
Gadolinium wird in Form von Gadoliniumoxid in modernen Brennelementen als abbrennbares Absorbermaterial verwendet, das nach einem Brennelementewechsel zu Beginn des Betriebszyklus die durch einen Überschuss an Kernbrennstoff entstehende zu hohe Reaktivität des Reaktors begrenzt. Mit zunehmendem Abbrand der Brennelemente wird auch das Gadolinium abgebaut.[7]
Mit Terbium dotiertes Gadolinium-Oxysulfid (Gd2O2S:Tb) ist ein in der Röntgentechnik häufig eingesetzter Szintillator. Gd2O2S:Tb emittiert Licht mit einer Wellenlänge von 545nm.
Es ist keine biologische Funktion des Gadoliniums bekannt.
Freie Gadolinium-Ionen verhalten sich ähnlich wie Calcium-Ionen, das heißt, sie werden vorwiegend in der Leber und im Knochensystem eingebaut und können dort über Jahre verbleiben. Freies Gadolinium beeinflusst außerdem als Calciumantagonist – die Ionenradien von Calcium und Gadolinium sind nahezu gleich – die Kontraktilität des Myokards und hemmt das Gerinnungssystem.[9]
Intravenös applizierte Lösungen von freien Gadolinium-Ionen wirken akut toxisch. Von der Toxizität betroffen sind unter anderem die glatte und die quergestreifte Muskulatur, die Funktion der Mitochondrien und die Blutgerinnung.[10]
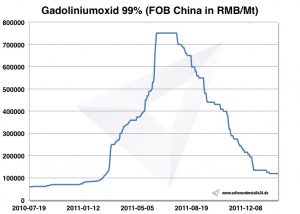
Die Toxizität von freiem Gadolinium ist als hoch einzustufen. In komplexierter Form, so wie das Gadolinium in den zugelassenen Kontrastmitteln vorliegt, ist es dagegen unter Berücksichtigung der Kontraindikationen im Allgemeinen gut verträglich. Seit 2006 gibt es zunehmend Berichte, dass es bei niereninsuffizienten Patienten nach Gabe verschiedener Chelate des Gadoliniums, insbesondere Gd-DTPA, zum Krankheitsbild der nephrogenen systemischen Fibrose kommen kann.
| Allgemein | |
| Name, Symbol
Ordnungszahl |
Gadolinium, Gd, 64 |
| Serie | Lanthanoide |
| Gruppe, Periode, Block | La, 6, f |
| Aussehen | silbrig weiß |
| CAS-Nummer | 7440-54-2 |
| Massenanteil an der Erdhülle | 5,9 ppm |
| Atomar | |
| Atommasse | 157,25 u |
| Atomradius | 188 pm |
| Kovalenter Radius | 196 pm |
| Elektronenkonf. | [Xe] 4f(7) 5d(1) 6s2 |
| 1. Ionisierungsenergie | 593,4 KJ/mol |
| 2. Ionisierungsenergie | 1170 KJ/mol |
| 3. Ionisierungsenergie | 1990 KJ/mol |
| Physikalisch | |
| Aggregatszustand | fest |
| Kristallstruktur | hexagonal |
| Dichte | 7,886 g/cm3 (25 °C) |
| Magnetismus | paramagnetisch (χm = 0,12) |
| Schmelzpunkt | 1585 K (1312 C) |
| Siedepunkt | 3523 K (3250 C) |
| Molares Volumen | 19,90 * 10(-6)m(3)/mol |
| Verdampfungswärme | 305 KJ/mol |
| Schmelzwärme | 10,0 KJ/mol |
| Elektrische Leitfähigkeit | 0,763*10(6) A/(V*m) |
| Wärmeleitfähigkeit | 11 W/(m*K) |