Tellur, Te, Ordnungszahl 52
Tellur Preis, Vorkommen, Gewinnung und Verwendung
Tellur [tʰɛˈluːɐ̯] (lat. tellus „Erde“) ist ein seltenes chemisches Element mit dem Elementsymbol Te und der Ordnungszahl 52. Im Periodensystem steht es in der sechsten Hauptgruppe, bzw. der 16. IUPAC-Gruppe, und 5. Periode und zählt damit zu den Chalkogenen. Seine Häufigkeit entspricht ungefähr der von Gold, mit dem es auch verschiedene Verbindungen eingeht, die in der Natur als Minerale auftreten. Kristallines Tellur ist ein silberweißes, metallisch glänzendes Halbmetall, das im Aussehen Zinn und Antimon ähnelt. Es reagiert spröde auf mechanische Belastung und kann daher leicht pulverisiert werden. In chemischen Verbindungen mit Nichtmetallen steht es in seinem Verhalten Schwefel und Selen nahe, in Legierungen und intermetallischen Verbindungen zeigt es jedoch sehr ausgeprägte (halb-)metallische Eigenschaften.
Geschichte
Tellur wurde 1782 von dem österreichischen Chemiker und Mineralogen Franz Joseph Müller von Reichenstein (1740–1825) bei Untersuchungen von Gold-Erzen aus der Grube Mariahilf am Berg Faczebaja bei Zlatna (dt. Klein Schlatten, ung. Zalatna) nahe Sibiu (dt. Hermannstadt, Siebenbürgen, Rumänien) entdeckt, die eine geringere Goldausbeute als erwartet erbrachten. Er war durch die wissenschaftliche Abhandlung Nachricht vom gediegenen Spiesglaskönig in Siebenbürgen von Ignaz von Born (1742–1791) auf die Erze aufmerksam geworden. Spiesglaskönig bezeichnet gediegenes Antimon, Spiesglas ist eine alte Bezeichnung für das Mineral Antimonit (Stibnit, Grauspießglanz Sb2S3). Von Born hielt das gediegene Metall in den Golderzen für Antimon und führte die geringe Ausbeute auf eine Verbindung des Goldes mit Antimon zurück. Müller von Reichenstein widersprach dieser Ansicht und hielt es zunächst für „geschwefelten Wismuth“. Nach weiteren Untersuchungen, deren Ergebnisse er zwischen 1783 und 1785 in einer vierteiligen Abhandlung publizierte, schloss er jedoch auch Bismut aus, da das Metall, im Gegensatz zu Antimon und Bismut, praktisch nicht mit Schwefelsäure reagierte. Er verlieh der metallischen Phase den Namen metallum problematicum (auch aurum problematicum beziehungsweise aurum paradoxum). Nach heutiger Erkenntnis besteht es neben gediegenem Tellur aus den Mineralen Nagyágit (Blättererz, AuPb(Pb,Sb,Bi)Te2–3S6) und Sylvanit (Schrifttellur, (Au,Ag)Te2). Müller von Reichenstein vermutete, dass metallum problematicum „…vielleicht ein neues bisher noch nicht gekanntes Halbmetall sei“, wollte seine Befunde jedoch erst von dem schwedischen Mineralogen und Chemiker Torben Olof Bergman (1735–1784) bestätigen lassen. Im Jahr 1783 schickte er Proben des Erzes zur Begutachtung an Bergman, jedoch erhielt er keine definitiven Antworten. Bergman verstarb 1784 und die Untersuchungen an metallum problematicum wurden 1785 vorerst eingestellt.
Erst zwölf Jahre später, im Jahr 1797, erhielt Martin Heinrich Klaproth (1743–1817) in Berlin Proben der Erze von Müller von Reichenstein. Klaproth bekräftigte die Schlussfolgerungen aus Müller von Reichensteins Untersuchungen und sah genügend Hinweise für die Entdeckung eines neuen Elements. Im Januar 1798 würdigte Klaproth die Verdienste Müller von Reichensteins in einem Vortrag und schrieb ihm die Entdeckung des neuen Elements zu. Da Müller von Reichenstein dem Element keinen Namen gegeben hatte, entschied sich Klaproth für den Namen Tellur (lat. tellus: „Erde“):
„Zur Ausfüllung dieser bisherigen Lücke in der chemischen Mineralogie lege ich hier meine mit diesen kostbaren Erzen angestellten Versuche und Erfahrungen dar, deren Hauptresultat in der Auffindung und Bestätigung eines neuen eigenthümlichen Metalls besteht, welchem ich den von der alten Mutter Erde entlehnten Nahmen Tellurium beilege.“
Die originalen Handstücke des Probenmaterials von der Typlokalität Zlatna, das Klaproth zur Verfügung hatte, befinden sich heute im Museum für Naturkunde in Berlin.
Unabhängig von Müller von Reichenstein und Klaproth entdeckte 1789 der ungarische Chemiker und Botaniker Paul Kitaibel (1757–1817) das Tellur bei Untersuchungen von Golderzen aus dem Bergbauort Nagybörzsöny (Deutsch-Pilsen) in Ungarn. Klaproth erwähnte in seinem veröffentlichten Vortrag jedoch nur Müller von Reichenstein, obwohl er seit 1796 durch ein Manuskript Kitaibels auch Kenntnis von seinen Untersuchungen hatte. In einem Brief an Kitaibel erklärte Klaproth, der Inhalt des Manuskripts sei ihm entfallen und er habe bei den Untersuchungen der Erze Müller von Reichensteins keinen Zusammenhang mit seiner Arbeit gesehen. Klaproth überzeugte Kitaibel schließlich, dass die Entdeckung des Tellurs allein Müller von Reichenstein zugeschrieben werden sollte, da dieser bereits einige Jahre früher dieselben Beobachtungen an dem neuen Element machte.
Das Elementsymbol „Te“ wurde 1814 von Jöns Jakob Berzelius (1779–1848) vorgeschlagen und wird bis heute verwendet. Die erste Strukturaufklärung von kristallinem Tellur mit Hilfe der Röntgenbeugung erfolgte 1924.
Vorkommen
Tellur ist ein selten vorkommendes Element; sein Anteil an der Erdkruste beträgt ca. 0,01 ppm (g/t). Mit Gold, untergeordnet auch mit Silber, Kupfer, Blei und Bismut sowie den Platinmetallen kommt es selten gediegen, also in elementarer Form in der Natur, vor.
Gediegen Tellur gehört als Mineral zur Gruppe der Elemente, genauer der Halb- und Nichtmetalle und wird in der Systematik der Minerale nach Strunz unter der Nummer I/B.03-40 (8. Auflage) bzw. 1.CC.10 (9. Auflage), und nach Dana unter der Nummer 1.3.4.2 geführt.
Spuren bis hin zu größeren Mengen an Selen können in gediegen Tellur enthalten sein (Selentellur). Obwohl es sich bei Tellur um ein seltenes Element handelt, ist eine relativ große Anzahl von Mineralen bekannt, denn Tellur bildet eigene Minerale, weil es nur selten in Sulfiden oder Seleniden beziehungsweise Sulfaten oder Selenaten eingebaut wird; für diese Kristallgitter der leichteren Homologen ist es zu groß. Umgekehrt dagegen vertreten die beiden leichteren Homologen häufiger das Tellur auf seinen Gitterplätzen in Kristallstrukturen tellurhaltiger Minerale.
Tellur zeigt von allen Elementen die höchste Affinität zu Gold und findet sich daher in der Natur häufig in Form von Gold-Telluriden, Mineralen mit Tellurid- (Te2−) beziehungsweise Ditellurid-Anionen (Te22−). Neben Gold und anderen Edelmetallen bilden vor allem Blei und Bismut weitere natürliche Telluride, oft begleitend (Paragenesen) zu den gediegenen Metallen und Gold-Erzen.
Seltener sind Minerale mit Te4+-Kationen in der Kristallstruktur, wobei auch das wichtigste Oxid des Tellurs, das Tellurdioxid TeO2 in zwei Modifikationen als orthorhombischer Tellurit und tetragonaler Paratellurit in der Natur auftritt. Bei den weiteren Mineralen mit Tellur(IV)-Kationen handelt es sich um Oxotellurate(IV) (Tellurite), die komplexe [TeO3]2−- oder [TeO4]4−-Anionen enthalten. Minerale mit Te6+-Kationen in Form von oktaedrischen [TeO6]6−-Komplexanionen sind äußerst selten, es sind 21 Minerale bekannt, die größtenteils Kupfer und Blei enthalten. Neben den genannten Mineralen existieren in der Natur auch gemischtvalente Tellurminerale, darunter das Calcium-Oxotellurat(IV,VI) Carlfriesit CaTe3O8 mit einem Te4+:Te6+-Verhältnis von 2:1.[14][15] Bei den Mineralen mit Te4+ und Te6+-Kationen handelt es sich um Sekundärminerale, die aus der Verwitterung von gediegen Tellur und Telluriden entstanden sind.
Tellurhaltige Minerale sind für die technische Gewinnung von Tellur ohne Bedeutung, da sie zu selten vorkommen und praktisch keine abbauwürdigen Lagerstätten existieren. Zu den bekannten Fundorten von gediegen Tellur beziehungsweise tellurhaltiger Minerale zählen neben der Typlokalität Zlatna (Siebenbürgen, Rumänien) auch Moctezuma (Mexiko), Cripple Creek (Colorado), Kalgoorlie (Australien) und Calaveras (Kalifornien). Bisher (Stand: 2012) sind 154 tellurhaltige Minerale bekannt, von denen allerdings fünf (Dilithium, Imgreit, Kurilit, Sztrokayit, Protojoseit) bisher noch nicht von der International Mineralogical Association (IMA) als eigenständige Minerale anerkannt bzw. als solche diskreditiert wurden.
Gewinnung und Darstellung
Tellur wird zusammen mit Selen industriell ausschließlich aus Nebenprodukten der großtechnischen elektrolytischen Kupfer- und Nickel-Herstellung gewonnen. In den anfallenden Anodenschlämmen sind wasserunlösliche Edelmetall-Telluride und -Selenide der allgemeinen Formel M2Ch (M = Cu, Ag, Au; Ch = Se, Te) enthalten, die bei Temperaturen oberhalb 500 °C unter Luftsauerstoff (O2) mit Soda (Natriumcarbonat Na2CO3) zur Reaktion gebracht werden. Die Edelmetall-Kationen (M+) werden dabei zu elementaren Metallen (M) reduziert, die Tellurid-Anionen zu Oxotelluraten(IV) (TeO32−) oxidiert:
Alternativ kann diese Umsetzung auch mit Salpeter (Natriumnitrat NaNO3) unter Luftausschluss und Bildung von Stickoxiden (NO und NO2) erfolgen:
Das entstandene Natriumtellurat(IV) Na2TeO3 wird anschließend in Wasser gelöst, wo es basisch reagiert und Hydrogentellurat(IV)-Ionen HTeO3− bildet. Die Abtrennung der Tellurate(IV) von den ebenfalls entstandenen Selenaten(IV) in der basischen Lösung erfolgt durch Neutralisation unter Zugabe von Schwefelsäure (H2SO4), wodurch in Wasser nahezu unlösliches Tellurdioxid TeO2 ausfällt:
Das Tellurdioxid kann entweder in Laugen durch Elektrolyse oder auf chemischem Weg durch Lösung in konzentrierten Mineralsäuren und Einleitung von Schwefeldioxid SO2 zu elementarem Tellur reduziert werden, wobei der Schwefel aus den SO2-Molekülen (bzw. den daraus in der Lösung gebildeten Sulfit-Ionen SO32−) oxidiert wird und Sulfat-Ionen (SO42−) entstehen:
Zur Gewinnung von hochreinem Tellur (> 99,9 %) wird das Zonenschmelzverfahren angewendet.
Die Weltjahresproduktion von Tellur ist von 298 Tonnen im Jahr 2013 um 53 % auf 457 Tonnen im Jahr 2017 gestiegen und lag damit bei durchschnittlich 382,8 Tonnen pro Jahr (t/a). Zu den Hauptproduzenten zählen China (∅ 220,0 t/a), die USA (∅ 50,0 t/a), Russland (∅ 35,6 t/a), Schweden (∅ 32,4 t/a), Japan (∅ 31,8 t/a) und Kanada (∅ 13,0 t/a). Eine Übersicht der Produktionsmengen der einzelnen Länder ist in der Tabelle dargestellt. Weitere Industrienationen wie Deutschland und Belgien produzieren wahrscheinlich ebenfalls Tellur, es liegen jedoch keine Zahlen vor.[17] Der United States Geological Survey (USGS) schätzt die weltweit verfügbaren Reserven von Tellur im Jahr 2019 auf rund 31.000 Tonnen.
| Land | 2013 | 2014 | 2015 | 2016 | 2017 | ∅ |
|---|---|---|---|---|---|---|
| China | 150 | 180 | 210 | 279 | 281 | 220,0 |
| USA | 50 | 50 | 50 | 50 | 50 | 50,0 |
| Russland | 31 | 33 | 34 | 40 | 40 | 35,6 |
| Schweden | 24 | 31 | 33 | 39 | 35 | 32,4 |
| Japan | 31 | 32 | 34 | 28 | 34 | 31,8 |
| Kanada | 12 | 9 | 9 | 18 | 17 | 13,0 |
| Summen | 298 | 335 | 370 | 454 | 457 | 382,8 |
 |
||||||
Modifikationen
Kristallines Tellur
Bei Standardbedingungen ist von Tellur nur eine kristalline Modifikation (Te-I oder α-Te) bekannt, die als kristallines oder metallisches Tellur bezeichnet wird. Es ist isotyp zu α-Selen, das heißt, es hat die gleiche Kristallstruktur. Tellur kristallisiert im trigonalen Kristallsystem in der Raumgruppe P3121 (Nr. 152) mit den Gitterparametern a = 446 pm und c = 592 pm und drei Formeleinheiten in der Elementarzelle (kleinste Baueinheit der Kristallstruktur).
Die nach der Hermann-Mauguin-Symbolik beschriebene Raumgruppe P3121 (Nr. 152) erläutert die Zentrierung der Elementarzelle sowie die vorhandenen Symmetrieelemente. P bedeutet, dass das Bravais-Gitter primitiv ist. Auf die Angabe der Zentrierung folgen die vorhandenen Symmetrieelemente der Raumgruppe: 31 beschreibt eine dreizählige Schraubenachse (Vervielfältigung eines Teilchens durch Drehung um 120° und Verschiebung (Translation) um 1/3 in Richtung der Drehachse) parallel zur kristallographischen c-Achse ([001]), 2 beschreibt eine zweizählige Drehachse (Vervielfältigung durch Drehung um 180°) parallel zu den drei kristallographischen a-Achsen (<100>), 1 das Symmetrieelement der einzähligen Symmetrieachse oder Identität (Vervielfältigung durch Drehung um 360°, das Teilchen bildet sich also auf sich selbst ab) in Richtung senkrecht zu den a-Achsen und der c-Achse (<120>).
Die Kristallstruktur enthält nur ein kristallographisch unterscheidbares Telluratom mit den Lagekoordinaten x = 0,2636, y = 0 und z = 1/3. Alle weiteren Atome der Kristallstruktur können durch die vorhandenen Symmetrieelemente der Raumgruppe auf dieses eine Atom zurückgeführt werden. Da das Telluratom in seiner Lage mit der zweizähligen Symmetrieachse der Raumgruppe (P3121 (Nr. 152)) zusammenfällt, wird es ausschließlich durch die dreizählige Schraubenachse (31) vervielfältigt. Dadurch entstehen spiralförmige Ketten aus kovalent gebundenen Telluratomen parallel zur c-Achse. Die Telluratome sind innerhalb der Kette 284 pm voneinander entfernt, der Bindungswinkel beträgt 103,1°. Die Bindungen innerhalb der Kette sind in den Abbildungen rot hervorgehoben, jeweils eine Kette ist zur Verdeutlichung blau dargestellt, wobei sich das dunkelblaue Atom auf z = 1/3, das mittelblaue auf z = 2/3 und das hellblaue auf z = 1 beziehungsweise z = 0 befindet. Jedes dritte Atom innerhalb der Kette ist also deckungsgleich. Jede Kette wird von sechs weiteren Ketten umgeben. Zwischen den Ketten existieren Van-der-Waals-Bindungen mit Te-Te-Abständen von 349 pm (grün gestrichelt), die durch die Unterschreitung des Van-der-Waals-Radius (2 · 206 pm = 412 pm) der Telluratome zustande kommen. Für ein einzelnes Telluratom ergibt sich dabei eine Koordinationszahl von 6, genauer 2+4, da 2 Atome aus der gleichen Kette stammen und damit einen geringeren Abstand als die weiteren 4 aus Nachbarketten aufweisen. Als Koordinationspolyeder ergibt sich damit ein verzerrtes Oktaeder (gelb hervorgehoben).
Tellur kann auch in der Raumgruppe P3221 (Nr. 154) statt P3121 (Nr. 152) kristallisieren. Die 32-Schraubenachse vervielfältigt ein Atom ebenfalls durch Drehung um 120°, anschließend wird es jedoch um 2/3 statt 1/3 in Richtung der Drehachse verschoben. Dadurch entstehen ebenfalls spiralförmige Ketten, die sich jedoch im Uhrzeigersinn statt im Gegenuhrzeigersinn (bei der 31-Schraubenachse) entlang der c-Achse winden. Die Kristallstruktur in der Raumgruppe P3221 (Nr. 154) („Linksform“) ist somit das Spiegelbild der Struktur in der Raumgruppe P3121 (Nr. 152) („Rechtsform“). Das Auftreten von spiegelbildlichen Kristallformen wird in der Kristallographie als Enantiomorphie bezeichnet.
Das Kristallsystem von Tellur wird oft als hexagonal angegeben. Dem hexagonalen und trigonalen Kristallsystem liegt die gleiche Elementarzelle zugrunde, jedoch würde eine hexagonale Symmetrie das Vorhandensein einer sechszähligen Symmetrieachse (6, Vervielfältigung eines Teilchens durch Drehung um 60°) voraussetzen. Die Kristallstruktur von Tellur beinhaltet jedoch nur die dreizählige Schraubenachse (31) und gehört damit zweifelsfrei in das niedriger symmetrische trigonale Kristallsystem.
In Hochdruckexperimenten mit kristallinem Tellur (Te-I oder α-Tellur) wurden weitere Modifikationen entdeckt. Die angegebenen Druckbereiche für die Stabilität der Modifikationen variieren zum Teil in der Literatur:
- Te-II kristallisiert im monoklinen Kristallsystem im Druckbereich von 4 bis 6,6 GPa. Als mögliche Raumgruppen werden in der Literatur C2/m (Nr. 12) und P21 (Nr. 4) genannt.
- Te-III kristallisiert im orthorhombischen Kristallsystem und ist im Druckbereich oberhalb 6,6 GPa stabil. Für eine orthorhombische Modifikation existiert eine theoretische Berechnung in der Raumgruppe Imma (Nr. 74).
- Te-IV kristallisiert im trigonalen Kristallsystem in der Raumgruppe R3m (Nr. 166) und entspricht der Struktur des β-Poloniums. Es ist im Druckbereich von 10,6 bis 27 GPa stabil. Die Abstände der Telluratome innerhalb der Ketten und zu benachbarten Ketten sind in dieser Modifikation gleich und betragen jeweils 300 pm, wodurch die höhere Symmetrie verglichen mit α-Te zustande kommt.
- Te-V ist oberhalb von 27 GPa stabil. Für diese Modifikation wird ein kubisch-raumzentriertes Gitter (Raumgruppe Im3m (Nr. 229)) angenommen.
Amorphes Tellur
Die unbeständige amorphe Modifikation ist ein braunes Pulver und kann aus Telluriger Säure (H2TeO3) durch Reaktion mit Schwefliger Säure (H2SO3) beziehungsweise Sulfit-Ionen (SO32−) dargestellt werden. Die Sulfit-Ionen werden dabei zu Sulfat-Ionen (SO42−) oxidiert während die Te4+-Kationen zu elementarem Tellur reduziert werden:
Amorphes Tellur wandelt sich unter Standardbedingungen langsam in die kristalline Modifikation um.
Physikalische Eigenschaften
Kristallines Tellur ist ein intrinsischer direkter Halbleiter mit einer Bandlücke von 0,334 eV. Die elektrische Leitfähigkeit lässt sich wie bei allen Halbleitern durch Temperaturerhöhung oder Belichtung steigern, dies führt bei Tellur jedoch nur zu einem geringen Anstieg. Die elektrische Leitfähigkeit und Wärmeleitfähigkeit verhält sich bei Tellur richtungsabhängig, das heißt anisotrop. Kristallines Tellur ist ein weiches (Mohshärte 2,25) und sprödes Material, das sich leicht zu Pulver verarbeiten lässt. Durch Druckerhöhung wandelt sich Tellur in weitere kristalline Modifikationen um. Oberhalb von 450 °C geht Tellur in eine rote Schmelze über, bei Temperaturen über 990 °C liegt Tellur als gelbes diamagnetisches Gas aus Te2-Molekülen vor. Bei Temperaturen über 2000 °C zerfallen die Te2-Moleküle in einzelne Atome.
Chemische Eigenschaften
Kristallines Tellur ist unlöslich in Wasser und schlecht löslich in den Mineralsäuren Salzsäure und Schwefelsäure sowie in Laugen. Gut löslich ist es hingegen in Salpetersäure, da diese ein sehr starkes Oxidationsmittel ist und elementares Tellur zu Telluraten mit der stabilen Oxidationsstufe +IV oxidiert. Tellurschmelzen greifen Kupfer, Eisen und rostfreien Edelstahl an.
In Verbindungen mit Nichtmetallen verhält sich Tellur wie das leichtere Gruppenmitglied Selen. An Luft verbrennt es in einer grün gesäumten, blauen Flamme zu Tellurdioxid TeO2:
Tellur reagiert spontan mit Halogenen unter Bildung von Tellurhalogeniden. Bemerkenswert ist hierbei, dass Tellur im Gegensatz zu den leichteren Homologen Selen und Schwefel auch thermodynamisch stabile Iodide bildet, darunter Telluriodid TeI mit der Oxidationsstufe +I. Mit unedlen Metallen wie zum Beispiel Zink reagiert es heftig zu den entsprechenden Telluriden.
Isotope
Von Tellur sind Isotope mit Massenzahlen zwischen 105 und 142 bekannt. Natürliches Tellur ist ein Mischelement, das aus acht Isotopen besteht, von denen fünf (122Te, 123Te, 124Te, 125Te, 126Te) stabil sind. Das Isotop 123Te sollte theoretisch unter Elektroneneinfang zu 123Sb zerfallen. Dieser Zerfall wurde jedoch noch nicht beobachtet; die untere Grenze für seine Halbwertszeit beträgt 9,2 · 1016 Jahre (92 Billiarden Jahre). Das Isotop 120Te geht über den doppelten Elektroneneinfang direkt in 120Sn über. Die Isotope 128Te und 130Te wandeln sich durch Emission von Betastrahlung (Doppelter Betazerfall) in 128Xe beziehungsweise 130Xe um.
Den größten Anteil an natürlichem Tellur bildet zu ungefähr einem Drittel das Isotop 130Te mit einer Halbwertszeit von 7,9 · 1020 Jahren, gefolgt vom Isotop 128Te. Die durchschnittliche Atommasse der natürlichen Tellur-Isotope beträgt daher 127,60 und ist damit größer als die des im Periodensystem folgenden Reinelements Iod mit 126,90. 128Te gilt als das Isotop mit dem langsamsten Zerfall aller nichtstabilen Isotope sämtlicher Elemente. Der äußerst langsame Zerfall mit einer Halbwertszeit von 7,2 · 1024 Jahren (7 Quadrillionen Jahren, d. h. in 1 Kilogramm zerfällt alle 18 Monate ein Atom) konnte nur aufgrund der Detektion des Zerfallsproduktes (128Xe) in sehr alten Proben natürlichen Tellurs festgestellt werden.
Von den übrigen Isotopen hat das Kernisomer 121mTe mit 154 Tagen die längste Halbwertzeit. Auch bei den Isotopen 127Te und 129Te liegen die Halbwertszeiten der Isomere über denen des Grundzustands. Als Tracer wird am häufigsten das Isotop 127Te verwendet, gefolgt von 121Te. Die Isotope 127Te und 129Te treten auch als Spaltprodukte bei der Kernspaltung in Atomreaktoren auf.
Verwendung
Tellur ist ein technisch weniger bedeutendes Element, da es teuer in der Herstellung ist und in der Verwendung häufig andere Elemente beziehungsweise Verbindungen gleichwertig sind. 2016 wurde für elementares, polykristallines und dotiertes Tellur thermoelektrisches Verhalten mit einer hohen Gütezahl im Bereich zwischen Raumtemperatur und 400 °C nachgewiesen. Elementares Tellur wird in der Metallindustrie unter anderem als Zusatz (< 1 %) für Stahl, Gusseisen, Kupfer- und Blei-Legierungen sowie in rostfreien Edelstählen verwendet. Es fördert die Korrosionsbeständigkeit und verbessert die mechanischen Eigenschaften sowie die Bearbeitbarkeit. Als Halbleiter wird reines Tellur bisher nur wenig eingesetzt, meist wird Tellur in II-VI-Verbindungshalbleitern verwendet. Cadmiumtellurid CdTe wird z. B. in Fotodioden und Dünnschicht-Solarzellen zur Stromerzeugung aus Licht verwendet.
Bismuttellurid Bi2Te3 wird in Thermoelementen zur Stromerzeugung in thermoelektrischen Generatoren (z. B. in Radionuklidbatterien) bzw. in Peltier-Elementen zur Kühlung eingesetzt.
Kombinationen aus Germanium- GeTe und Antimon-Telluriden Sb2Te3 werden in Phasenwechselmaterialien als Bestandteil optischer Speicherplatten (z. B. CD-RW) oder in neuartigen Speichermaterialien wie Phase Change Random Access Memory verwendet.
Gläser aus Tellurdioxid TeO2 werden aufgrund der hohen Brechungsindices anstelle von Kieselglas SiO2 in Lichtwellenleitern eingesetzt.
In der Mikrobiologie wird mit farblosem Kaliumtellurat(IV) K2TeO3 versetzter Agar als selektives Nährmedium zum Nachweis von Staphylokokken und Corynebacterium diphtheriae benutzt. Die Bakterienkolonien erscheinen dabei als kleine schwarze Kugeln, da sie die Te4+-Kationen zu elementarem Tellur reduzieren und in ihre Zellen einlagern.
Medizinische Verwendung fand Tellur (bzw. Kaliumtellurat) erstmals 1890 zur Behandlung von nächtlichen Schweißausbrüchen bei an Tuberkulose erkrankten Patienten.
Weiterhin werden geringe Mengen von Tellur zur Vulkanisierung von Gummi, in Sprengkapseln und zum Färben von Glas und Keramik verwendet. Die Salze des Tellurs werden teilweise zur Erzeugung einer grasgrünen Farbgebung bei Feuerwerken verwendet.
Sicherheitshinweise und Toxizität
Tellur ist in löslicher Form ein für den menschlichen Organismus giftiges Element und wurde daher in der Vergangenheit als giftig eingestuft. Da elementares Tellur jedoch sehr schlecht in Wasser und körpereigenen Säuren löslich ist, wurde es auf gesundheitsschädlich herabgestuft. Studien der Niederländischen Organisation für Angewandte Naturwissenschaftliche Forschung (TNO) zeigten, dass der LD50 (oral)-Wert für Ratten bei > 5000 mg/kg liegt. Der in vielen Sicherheitsdatenblättern angegebene Wert von 83 mg/kg aus dem Buch Toxicometric Parameters of Industrial Toxic Chemicals under single Exposure von N.F. Ismerow, der aus dem Jahr 1982 stammt,[26] gilt nur für leichtlösliche Tellurverbindungen. Trotzdem verwenden verschiedene Hersteller für elementares Tellur (Pulver) weiterhin den alten LD50-Wert und die Einstufung giftig in Verbindung mit dem H-Satz 301 („Giftig beim Verschlucken“).
Tellur ist nicht so giftig wie das Selen. Dies steht in Analogie zu den benachbarten Elementen der 5. Hauptgruppe, wo das Antimon ebenfalls weniger giftig als das Arsen ist. Gelangt Tellur vor allem in Form von leichtlöslichen Tellurverbindungen wie Alkalimetall-Tellurate (zum Beispiel Na2TeO3) durch Verschlucken (peroral) in den Körper, bildet sich durch Reduktion giftiges Dimethyltellurid (Me2Te: H3C−Te−CH3), das zur Schädigung von Blut, Leber, Herz und Nieren führen kann. Da leichtlösliche Tellurverbindungen dabei weit mehr Tellur freisetzen, werden diese auch als gefährlicher eingestuft. Tellurvergiftungen machen sich durch einen intensiven, zuerst 1824 von Christian Gottlob Gmelin (bei seinen erstmals vorgenommenen Untersuchungen der Wirkung von Tellur auf Lebewesen) beschriebenen Knoblauchgeruch der Atemluft bemerkbar, der durch das Dimethyltellurid hervorgerufen wird. Dieser entfernt sich erst nach mehreren Wochen und entfaltet sich selbst bei sehr geringen Mengen, die noch keine schwerwiegenden Vergiftungen hervorrufen. Dieser Knoblauchgeruch kann, im Gegensatz zu echtem Knoblauch, nicht durch Zähneputzen entfernt werden. Auch setzt dieser sich in einem Raum fest und entfernt sich erst nach mehreren Stunden. Es wird ebenfalls über die Haut langsam ausgeschieden.
Tellurstäube können sich in Luft selbst entzünden und fein verteilt in entsprechender Konzentration auch explosiv reagieren, wobei sich jeweils Tellurdioxid TeO2 bildet. Wie andere Metallstäube kann Tellurpulver auch mit Interhalogenverbindungen wie Brompentafluorid BrF5 explosiv reagieren. Eine Maximale Arbeitsplatz-Konzentration (MAK) für Tellur ist nicht festgelegt.
Nachweis
Elementares Tellur kann in heißer konzentrierter Schwefelsäure (H2SO4) durch Oxidation des Tellurs unter Bildung des roten Te42+-Kations (Tetratellur-Dikation) nachgewiesen werden. Ein Teil der Schwefelsäure wird bei der Reaktion zu Schwefliger Säure (H2SO3) reduziert, die aufgrund der hohen Temperaturen in Wasser (H2O) und ihr Anhydrid Schwefeldioxid (SO2) zerfällt, welches als Gas entweicht:
Die Farbe des quadratisch-planar aufgebauten Te42+-Kations kommt durch sechs delokalisierte π-Elektronen zustande, die einen Teil des sichtbaren Lichts absorbieren. Die übrigen, nicht absorbierten Wellenlängen des Lichts ergeben die Komplementärfarbe Rot.
Tellurat und Tellurit können mittels Polarographie speziiert, d. h. selektiv nebeneinander bestimmt werden. Während die Stufe des Tellurats bei −1,66 V liegt, erscheint diejenige des Tellurits bei −1,22 V (gegen SCE, 0,1 M Natronlauge). Beide Tellurspezies werden dabei in einem Schritt zum Tellurid reduziert. Spuren von 0,03 % Tellurat bzw. 0,003 % Tellurit sind auf diese Weise erfassbar. Wesentlich nachweisstärker sind die Methoden der Atomspektroskopie. Während man mit der Flammen-AAS eine Nachweisgrenze von 20 µg/l erreicht, liegt dieser Wert bei der Graphitrohr-AAS (0,2 µg/l) sowie der Hydridtechnik (0,02 µg/l) noch wesentlich niedriger.
Tellurverbindungen
In Verbindungen tritt Tellur am häufigsten in den Oxidationsstufen −II (Telluride) und +IV (Tetrahalogenide, Tellurdioxid und Tellurate(IV), veraltet Tellurite) auf. Seltener sind die Oxidationsstufen +VI (Tellurate(VI)) und +II (Dihalogenide) sowie −I (Ditelluride) und +I (Monohalogenide, nur bekannt als TeI).
Wasserstoffverbindungen
Tellurwasserstoff H2Te ist ein farbloses, sehr giftiges Gas, das durch Reaktion von Telluriden (MxTey) mit starken Säuren, zum Beispiel Salzsäure HCl, entsteht. Aus den Elementen (Wasserstoff und Tellur) ist die Verbindung als stark endotherme Verbindung nur bei Temperaturen über 650 °C darstellbar. In Wasser gelöst (Tellurwasserstoffsäure) reagiert es sauer, wobei die Säurestärke in etwa der Phosphorsäure entspricht. An der Luft zersetzt sich die wässrige Lösung umgehend zu Wasser und elementarem Tellur.
Sauerstoffverbindungen
Tellurdioxid (Tellur(IV)-oxid) TeO2 ist ein farbloser kristalliner Feststoff und das wichtigste Oxid des Tellurs. Es entsteht bei der Verbrennung von elementarem Tellur mit Luft. Es ist das Anhydrid der schwach amphoteren und unbeständigen Tellurigen Säure H2TeO3. Tellurdioxid existiert in einer orthorhombischen (Tellurit) und einer tetragonalen (Paratellurit) Modifikation, die in der Natur auch als Minerale auftreten.
Tellurtrioxid (Tellur(VI)-oxid) TeO3 ist ein gelber, trigonal/rhomboedrisch kristallisierender Feststoff und das Anhydrid der Orthotellursäure H6TeO6. Es entsteht bei der Entwässerung der Orthotellursäure durch starke Temperaturerhöhung. Die gelbe Farbe kommt durch Elektronenübertrag des Sauerstoffs auf das Tellur („Charge-Transfer“) zustande.
Tellurmonoxid (Tellur(II)-oxid) TeO ist ein weiteres, bei Standardbedingungen jedoch instabiles Oxid des Tellurs. Es wird als schwarzer amorpher Feststoff beschrieben und reagiert in feuchter Luft mit Sauerstoff zum stabileren Tellurdioxid TeO2.
Ditellurpentoxid (Tellur(IV)-Tellur(VI)-oxid) ist ein gemischtes Telluroxid mit Te4+- und Te6+-Kationen. Es ist neben Tellurtrioxid ein weiteres Produkt bei der thermischen Zersetzung der Orthotellursäure und kristallisiert im monoklinen Kristallsystem.
Tellurate sind die Salze der Orthotellursäure H6TeO6 und Metatellursäure H2TeO4 mit den Anionen [TeO6]6− beziehungsweise [TeO4]2−. Die Salze der Tellurigen Säure H2TeO3 mit dem Anion [TeO3]2− werden als Tellurate(IV) (veraltet Tellurite) bezeichnet.
Halogenverbindungen
Tetrahalogenide TeX4 mit Tellur in der Oxidationsstufe +IV sind die häufigsten Tellur-Halogenide. Diese sind mit allen Halogenen (Fluor, Chlor, Brom und Iod) bekannt. Bei allen Verbindungen handelt es sich kristalline Feststoffe.
Dihalogenide TeX2 mit Tellur in der Oxidationsstufe +II sind nur mit Chlor, Brom und Iod bekannt, sie existieren nur in der Gasphase.
Monohalogenide TeX existieren von Tellur nur mit Iod als Telluriodid TeI. Es ist das einzig bekannte thermodynamisch stabile Mono-Iodid der Chalkogene und ein dunkler kristalliner Feststoff. Tellur hat in dieser Verbindung die ungewöhnliche Oxidationsstufe +I.
Subhalogenide enthalten Te mit einer Oxidationsstufe, die kleiner als +I ist. Stabile Vertreter sind Te2I, Te2Br und Te3Cl2.
Hexahalogenide TeX6 mit Tellur in der Oxidationsstufe +VI sind nur als Tellurhexafluorid TeF6 oder Tellurpentafluoridchlorid TeF5Cl bekannt. Beides sind farblose Gase. Tellurhexafluorid ist das reaktivste Chalkogenhexafluorid (neben Schwefelhexafluorid SF6 und Selenhexafluorid SeF6) und wird als einziges in Wasser hydrolysiert.
Weiterhin existieren von Tellur in der Oxidationsstufe +IV in wässriger Lösung auch Komplexverbindungen [TeX6]2− (X = F−, Cl−, Br−, I−) mit allen Halogenid-Ionen. Mit Ausnahme des Hexafluoro-Komplexes sind alle anderen perfekt oktaedrisch aufgebaut und können auch als Salze aus der Lösung gefällt werden (zum Beispiel gelbes Ammonium-hexachloridotellurat(IV) (NH4)2[TeCl6], rotbraunes Ammonium-hexabromidotellurat(IV) (NH4)2[TeBr6] oder schwarzes Cäsium-hexaiodidotellurat(IV) Cs2[TeI6]).
Organotellur-Verbindungen
Tellur bildet eine Reihe von metallorganischen Verbindungen. Diese sind aber sehr instabil und werden in der organischen Synthese wenig verwendet. Als reine Tellurorganyle sind Verbindungen der Form R2Te, R2Te2, R4Te und R6Te (R jeweils Alkyl-, Aryl-) bekannt.
Daneben sind noch Diorganotellurdihalogenide R2TeX2 (R = Alkyl-, Aryl-; X = F, Cl, Br, I) und Triorganotellurhalogenide R3TeX (R = Alkyl-, Aryl-; X = F, Cl, Br, I) bekannt.
Tellurpolykationen
Polykation Te72+ in Te7[Be2Cl6]
Durch vorsichtige Oxidation von Tellur können neben dem schon erwähnten Te42+ zahlreiche Tellurpolykationen Tenx+ dargestellt und mit einem geeigneten Gegenion kristallisiert werden. Das Gegenion muss eine schwache Lewis-Base sein, da die Tellurpolykationen verhältnismäßig starke Lewissäuren sind. Geeignete Oxidationsmittel sind häufig Halogenide der Übergangsmetalle, die bei Temperaturen von typischerweise 200 °C direkt die gewünschte Verbindung ergeben:
Häufig ist die Kristallisation unter den Bedingungen des chemischen Transports erfolgreich, bisweilen müssen aber wasserfreie Lösungsmittel wie Zinn(IV)-chlorid oder Siliciumtetrabromid verwendet werden. Auch Salzschmelzen stellen in Einzelfällen geeignete Reaktionsmedien dar. Ist das Metallhalogenid kein geeignetes Oxidationsmittel, wie das bei Halogeniden der Hauptgruppenelemente in der Regel der Fall ist, können die entsprechenden Tellurtetrahalogenide als Oxidationsmittel verwendet werden:
Durch Variation des Gegenions und des Reaktionsmediums konnte eine große Vielfalt von Polykationen dargestellt werden; auch gemischte Selen-Tellurpolykationen sind durch entsprechende Wahl der Reaktanten der Synthese zugänglich. Neben den gezeigten ketten- bzw. bandförmigen Polykationen gibt es auch isolierte Polykationen wie Te62+, Te64+ und Te84+.
Tellur Preis
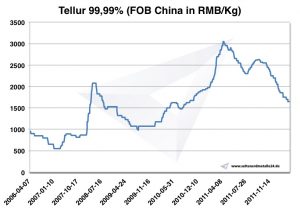
Chart Tellur 2006-2011
Tellur Preise -> Preise für Strategische Metalle










![{\mathrm {8\ Te\ +\ 2\ UBr_{5}\longrightarrow \ Te_{8}[U_{2}Br_{{10}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/766123b2cbd2af42e846172c00731419fb95bc1b)
![{\mathrm {13\ Te\ +\ TeCl_{4}\ +\ 4\ BeCl_{2}\longrightarrow \ 2\ Te_{7}[Be_{2}Cl_{6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d391160b6e1fdb357b4a11ea7abd720a1cb0ba)