Magnesium, Mg, Ordnungszahl 12
Magnesium Preis, Geschichte, Vorkommen, Gewinnung und Verwendung
Magnesium ist ein chemisches Element mit dem Elementsymbol Mg (Alchemie: ⚩) und der Ordnungszahl 12. Im Periodensystem der Elemente steht es in der zweiten Hauptgruppe bzw. der 2. IUPAC-Gruppe und gehört damit zu den Erdalkalimetallen.
Magnesium ist eines der zehn häufigsten Elemente der Erdkruste. Es kommt in zahlreichen Mineralen sowie im Blattgrün der Pflanzen vor.
Geschichte
Die Herkunft der Elementbezeichnung wird in der Literatur unterschiedlich dargestellt:
- von altgriechisch μαγνησία λίθος in der Bedeutung „Magnetstein“,
- von Magnisia, einem Gebiet im östlichen Griechenland,
- von Magnesia, einer Stadt in Kleinasien auf dem Gebiet der heutigen Türkei.
Allerdings scheinen alle angegebenen Herleitungen etymologisch wiederum von den Magneten bzw. deren eponymen Heros Magnes herzustammen.
Magnesiumverbindungen waren schon Jahrhunderte vor der Herstellung elementaren Magnesiums bekannt und in Gebrauch. Magnesia alba bezeichnete Magnesiumcarbonat, während Magnesia der gebräuchliche Name für Magnesiumoxid war.
Der schottische Physiker und Chemiker Joseph Black war der erste, der Magnesiumverbindungen im 18. Jahrhundert systematisch untersuchte. 1755 erkannte er in seinem Werk De humore acido a cibis orto et Magnesia alba den Unterschied zwischen Kalk (Calciumcarbonat) und Magnesia alba (Magnesiumcarbonat), die zu dieser Zeit oft verwechselt wurden. Er fasste Magnesia alba als Carbonat eines neuen Elements auf. Deswegen wird Black oft als Entdecker des Magnesiums genannt, obwohl er nie elementares Magnesium darstellte.
1808 gewann Sir Humphry Davy Magnesium durch Elektrolyse angefeuchteten Magnesiumhydroxids mit Hilfe einer Voltaschen Säule – allerdings nicht in reiner Form, sondern als Amalgam, da er mit einer Kathode aus Quecksilber arbeitete. So zeigte er, dass Magnesia das Oxid eines neuen Metalls ist, das er zunächst Magnium nannte.
1828 gelang es dem französischen Chemiker Antoine Bussy durch das Erhitzen von trockenem Magnesiumchlorid mit Kalium als Reduktionsmittel, geringe Mengen von reinem Magnesium darzustellen. 1833 stellte Michael Faraday als erster Magnesium durch die Elektrolyse von geschmolzenem Magnesiumchlorid her. Basierend auf diesen Versuchen arbeitete der deutsche Chemiker Robert Wilhelm Bunsen in den 1840er und 1850er Jahren an Verfahren zur Herstellung von Magnesium durch Elektrolyse von Salzschmelzen mit Hilfe des von ihm entwickelten Bunsenelements. 1852 entwickelte er eine Elektrolysezelle zur Herstellung größerer Mengen von Magnesium aus geschmolzenem, wasserfreien Magnesiumchlorid. Dieses Verfahren ist bis heute zur Gewinnung von Magnesium bevorzugt.
Die technische Erzeugung von Magnesium begann 1857 in Frankreich nach einem Verfahren von Henri Etienne Sainte-Claire Deville und H. Caron. Beim sogenannten Deville-Caron-Prozess wird ein Gemisch aus wasserfreiem Magnesiumchlorid und Calciumfluorid mit Natrium reduziert. In England begann die Firma Johnson Matthey um 1860 mit der Magnesiumherstellung nach einem ähnlichen Verfahren. Aufgrund von Fabrikationsschwierigkeiten blieben diese frühen Unternehmungen allerdings unwirtschaftlich.
Vorkommen
Magnesium kommt in der Natur wegen seiner Reaktionsfreudigkeit nicht in elementarer Form vor. Als Mineral tritt es überwiegend in Form von Carbonaten, Silicaten, Chloriden und Sulfaten auf. In Form von Dolomit ist ein Magnesiummineral sogar gebirgsbildend, so z. B. in den Dolomiten.
Die wichtigsten Mineralien sind Dolomit CaMg(CO3)2, Magnesit (Bitterspat) MgCO3, Olivin (Mg, Fe)2 [SiO4], Enstatit MgSiO3 und Kieserit MgSO4 · H2O.
Andere Mineralien sind:
- Serpentin Mg3[Si2O5] (OH)4
- Talk Mg3[Si4O10] (OH)2
- Sepiolith Mg4[Si6O15] (OH)2
- Schönit K2Mg(SO4)2 · 6 H2O
- Carnallit KMgCl3 · 6 H2O
- Spinell MgAl2O4
In Wasser gelöst, verursacht es zusammen mit dem Calcium die Wasserhärte. Im Meerwasser ist es zu mehr als 1 kg/m³ enthalten.
Gewinnung und Darstellung
Die Gewinnung von Magnesium erfolgt vorwiegend über zwei Wege:
- Durch Schmelzflusselektrolyse von geschmolzenem Magnesiumchlorid in Downs-Zellen: Downs-Zellen bestehen aus großen eisernen Trögen, die von unten beheizt werden. Als Anoden dienen von oben eingelassene Graphitstäbe, die an den Spitzen von einer ringförmigen Kathode umgeben sind. Das metallische Magnesium sammelt sich auf der Salzschmelze und wird abgeschöpft. Das entstehende Chlorgas sammelt sich im oberen Teil der Zelle und wird wieder verwendet zur Herstellung von Magnesiumchlorid aus Magnesiumoxid. Zur Schmelzpunkterniedrigung des Magnesiumchlorids wird der Salzschmelze Calcium- und Natriumchlorid zugesetzt.
- Durch thermische Reduktion von Magnesiumoxid (Pidgeon-Prozess): In einem Behälter aus Chrom-Nickel-Stahl wird gebrannter Dolomit, Schwerspat und ein Reduktionsmittel wie Ferrosilicium, eingefüllt. Anschließend wird evakuiert (Abpumpen des Gases) und auf 1160 °C erhitzt. Das dampfförmige Magnesium kondensiert am wassergekühlten Kopfstutzen außerhalb des Ofens. Das chargenweise gewonnene Magnesium wird durch Vakuumdestillation weiter gereinigt.
Der Pidgeon-Prozess ist heute der bedeutendste Herstellungsprozess und wird hauptsächlich in China verwendet.
88 % der weltweiten Magnesiumproduktion findet in China statt, dort wurden 2015 ca. 800.000 t Magnesiummetall produziert. Danach folgen mit jeweils nur wenigen Prozent Marktanteil Russland, Israel und Kasachstan.
Bei der Produktion von 1 kg Magnesium durch den Pidgeon-Process entstehen Treibhausgase mit einem CO2-Äquivalent von etwa 31 kg (zum Vergleich: Für 1 kg Stahl entstehen zwischen 0,5 und 2 kg CO2-Äquivalente).
Obwohl Magnesium in mehr als 60 Mineralien enthalten ist, sind nur Dolomit, Magnesit, Brucit, Carnallit, Talk und Olivin von kommerzieller Bedeutung.
Das Mg2+-Kation ist das im Meerwasser am zweithäufigsten vorkommende Kation, was Meerwasser und Meersalz zu attraktiven kommerziellen Quellen für Magnesium macht. Um es zu extrahieren, wird Calciumhydroxid zu Meerwasser gegeben, um einen Niederschlag aus Magnesiumhydroxid zu bilden.
Magnesiumhydroxid (Brucit) ist wasserunlöslich und kann abfiltriert und mit Salzsäure zu konzentriertem Magnesiumchlorid umgesetzt werden.
Durch Elektrolyse entsteht aus Magnesiumchlorid Magnesium.
Eigenschaften
Das feste, silbrig glänzende Leichtmetall Magnesium ist etwa ein Drittel leichter als Aluminium. Reinmagnesium hat eine geringe Festigkeit und Härte. Sein E-Modul liegt bei etwa 45 GPa. An Luft überzieht sich Magnesium mit einer Oxidschicht, die im Gegensatz zu Aluminium nicht vollständig deckend ist. Grund dafür ist, dass das Magnesiumoxid ein geringeres Molvolumen als Magnesium selbst hat (MgO: 10,96 cm3/mol, Mg: 13,96 cm3/mol); s. Pilling-Bedworth-Verhältnis.
Dünne Bänder oder Folien lassen sich leicht entzünden. Es verbrennt an der Luft mit einer grellweißen Flamme zu Magnesiumoxid MgO und wenig Magnesiumnitrid Mg3N2. Frisch hergestelltes Magnesiumpulver kann sich an der Luft bis zur Selbstentzündung erwärmen. Gefährliche Reaktionen sind bei höheren Temperaturen, das heißt besonders bei Schmelzflüssigem zu erwarten. Auch in vielen Oxiden wie Kohlenstoffmonoxid, Stickoxid und Schwefeldioxid verbrennt Magnesium.
Mit Wasser reagiert Magnesium unter Bildung von Wasserstoff:
Reaktion von Magnesium mit Wasser
Dabei bildet sich ein schwer löslicher Überzug aus Magnesiumhydroxid, der die Reaktion weitgehend zum Erliegen bringt (Passivierung). Schon schwache Säuren, wie beispielsweise Ammoniumsalze, genügen um die Hydroxidschicht zu lösen, da sie die Hydroxidionen zu Wasser umsetzen und sich lösliche Salze bilden. Ohne Passivierung verläuft die exotherme Reaktion heftig; je feiner der Magnesiumstaub, desto heftiger. Mit Luft bildet der freigesetzte Wasserstoff leicht ein explosionsfähiges Gemisch (Knallgas).
Magnesium reagiert mit Kohlenstoffdioxid exotherm unter Bildung von Magnesiumoxid und Kohlenstoff:
Reaktion von Magnesium mit Kohlenstoffdioxid
Daher löscht Kohlendioxid Magnesiumbrände nicht, sondern befeuert sie.
Gegen Fluorwasserstoffsäure und Basen ist es im Gegensatz zum Aluminium relativ beständig. Grund dafür ist die geringe Löslichkeit des als Überzug gebildeten Magnesiumfluorids (MgF2), die eine weitere Bildung von Mg(OH)3−-Ionen verhindern.
Isotope
Es sind insgesamt 21 Isotope zwischen 19Mg und 40Mg des Magnesiums bekannt. Von diesen sind drei, die Isotope 24Mg, 25Mg und 26Mg stabil und kommen in der Natur vor. Das Isotop mit dem größeren Anteil an der natürlichen Isotopenzusammensetzung ist 24Mg mit 78,99 %, 25Mg hat einen Anteil von 10,0 % und 26Mg von 11,01 %. Die langlebigsten instabilen Isotope sind 28Mg, das mit einer Halbwertszeit von 20,915 Stunden unter Betazerfall in 28Al übergeht und 27Mg, das mit einer Halbwertszeit von 9,435 Minuten ebenfalls unter Betazerfall zu 27Al zerfällt. Alle anderen Isotope haben nur kurze Halbwertszeiten von Sekunden oder Millisekunden.
Verwendung
Metallisches Magnesium
Magnesiumpulver und -draht wird in Brandsätzen, -bomben und Leuchtmunition, früher auch als Blitzlichtpulver verwendet. Häufig dienen Magnesiumstäbe als Opferanoden, die Teile aus edleren Metallen vor Korrosion schützen.
In der Metallurgie findet Magnesium vielseitige Verwendung,
- als Reduktionsmittel im Kroll-Prozess zur Gewinnung von Titan,
- als Reduktionsmittel zur Gewinnung von Uran, Kupfer, Nickel, Chrom und Zirconium,
- als Bestandteil von Aluminiumlegierungen der Gruppen AlSiMg und AlMg,
- als Magnesiumgranulat zur Entschwefelung von Eisen und Stahl,
- als Zuschlagstoff für Kugelgraphitguss,
- als Basis einer Gruppe genormter Leichtlegierungen für den Bau von Luft- und Kraftfahrzeugen (diese Schmelzen benötigen eine Abdeckschicht aus geschmolzenem Magnesiumchlorid zum Schutz vor Luftzutritt und Oxidation, s. Schmelzebehandlung),
- als Brennstoff für Fackeln, die unter Wasser brennen.
In der organischen Chemie wird es zur Herstellung von Grignard-Verbindungen genutzt.
Weil sich Magnesium sehr leicht entzündet, wird es auch als sehr robustes Feuerzeug verwendet. Diese als Fire Starter Kits vertriebenen Magnesiumblöcke haben auf einer Seite einen Stab, dessen Abrieb sich an der Luft spontan entzündet, wie der Feuerstein eines Feuerzeugs. Die Prozedur ähnelt stark der in der Steinzeit üblichen Methode, durch Feuerstein und Zunder Feuer zu machen, wobei das Magnesium die Rolle des Zunders übernimmt. Zuerst werden mit einem Messer Späne vom Magnesiumblock abgeschabt und auf oder unter dem eigentlichen Brennmaterial platziert. Anschließend werden durch Schaben am rückwärtigen „Feuerstein“ (z. B. mit dem Rücken des Messers) Funken möglichst nahe an den Magnesiumspänen erzeugt, um diese zu entzünden.
Magnesiumlegierungen
Die wichtigste Eigenschaft von Magnesiumlegierungen, die ihnen gegenüber Aluminium und seinen Legierungen zu Bedeutung verholfen hat, ist der mit ihnen mögliche Leichtbau. Mit einer Dichte von rund 1,75 g/cm³ ist der Unterschied zu Aluminiumleichtbau mit einer Dichte um 2,75 g/cm³ deutlich. Hinzu kommt, dass der Schmelzbereich zwischen 430 und 630 °C, also energiesparend niedriger liegt. Die mechanischen Eigenschaften wie Zugfestigkeit und Härte liegen jedoch deutlich tiefer als bei Aluminiumlegierungen. Die niedere Dichte machte Magnesium schon früh für mobile Anwendungen interessant. Die erste Großanwendung fand schon vor dem Ersten Weltkrieg beim Bau des Gerüstes für die starren Zeppelinluftschiffe statt. In Kraftfahrzeugen nutzte man Magnesiumlegierungen zur Herstellung von Gehäuseteilen sowie zur Herstellung von Felgen für Mobile aller Art. Nach 1930 verwendete man Magnesiumlegierungen zunehmend im Flugzeugbau, denn die mit ihnen möglichen Gewichtseinsparungen, erlaubten energieeffizientere Flüge wie auch höhere Zuladung. All dies führte zu einem raschen Ausbau der Magnesiumerzeugung in Deutschland (Elektron aus der Chemischen Fabrik Griesheim) und nach 1940 auch in den USA. „Elektron“ wurde unmittelbar nach Produktionsanlauf zum markenrechtlich geschützten Namen für die ersten Magnesiumlegierungen.
Andere Verwendungsmöglichkeiten für Magnesiumguss boten sich im Zuge der technischen Entwicklung an, teils kriegsbedingt, teils konstruktiv vorausschauend und zugleich die Legierungen optimierend. Als Werkstoffe auf Magnesiumbasis wurden die Legierungen Mg-Al-, Mg-Mn-, Mg-Si-, Mg-Zn- und schließlich Mg-Al-Zn-Legierungen entwickelt.
Die Getriebegehäuse des VW Käfers wurde in Millionenauflage aus einer Mg-Si-Legierung gegossen. Heute werden Magnesiumlegierungen nicht allein unter dem Gesichtspunkt Gewichtsersparnis verwendet, sondern sie zeichnen sich zudem durch hohe Dämpfung aus. Dies führt bei Schwingungsbelastung zu einer Verringerung der Vibration und Geräuschemission. Auch aus diesem Grunde sind Magnesiumlegierungen interessante Werkstoffe im Motorenbau, wie überhaupt im Automobilbau geworden. So werden nicht nur Teile des Motors aus Magnesiumlegierung hergestellt, sondern zunehmend auch für den Guss von Motorblöcken das Hybridverfahren/Hybridguss angewendet, erstmals in der Großserie im Alfa Romeo 156, später auch bei BMW (siehe hierzu auch BMW N52).
Im Druckgießverfahren (siehe auch unter Formguss) lassen sich viele, auch großflächige, dünnwandige Bauteile endabmessungsnah und ohne kostenintensive Nachbearbeitung herstellen, so z. B. Felgen, Profile, Gehäuse, Türen, Motorhauben, Kofferraumdeckel, Handbremshebel und anderes. Nicht nur im Automobilbau, auch im Maschinenbau wird mit Teilen aus Mg-Al-Zn-Legierungen konstruiert.
Die Bestrebungen nach Leichtbau führten bereits zu Ende des 20. Jahrhunderts zu Magnesium-Lithium-Legierungen, noch leichteren Legierungen aus Magnesium mit Zusatz von Lithium.
Magnesiumwerkstoffe in der Medizin
Jüngste Forschungen versprechen ein hohes Entwicklungspotenzial von Magnesiumwerkstoffen als resorbierbares Implantatmaterial (z. B. als Stent) für den menschlichen Körper. Magnesiumwerkstoffe müssen in der Anwendung vor Kontaktkorrosion geschützt werden. Die Korrosionsbeständigkeit gegen normale atmosphärische Einflüsse ist hingegen gut. Das Kontaktkorrosionsverhalten wäre bei einer Verwendung als zeitlich begrenzt einzusetzendes Implantatmaterial ein entscheidender Vorteil, da es sich nach einer bestimmten Zeit gefahrlos auflösen würde. Damit entfielen Risiken und Kosten einer Operation zur Implantatentnahme.
Düngemittel
Bei der Kalkung von Acker- und Grünlandflächen kommt Magnesium in Form von Magnesiumoxid oder Magnesiumcarbonat zum Einsatz, um den Magnesiumentzug des Bodens durch die Pflanzen wieder auszugleichen. Weiterhin wird der Boden-pH-Wert angehoben und die Verfügbarkeit weiterer Nährstoffe verbessert. Hierbei wird die Magnesiumverbindung meist zusammen mit Kalk als magnesium- und calciumhaltiger Mehrnährstoffdünger angewendet. Auch das natürlich als Bobierrit vorkommende Magnesiumphosphat Mg3(PO4)2 (Trimagnesiumphosphat) sowie Magnesiumnitrat werden als Mehrnährstoffdünger verwendet.
Physiologie
Magnesium gehört zu den Essentiellen Stoffen und ist daher für alle Organismen unentbehrlich. Im Blattgrün der Pflanzen, dem Chlorophyll, ist Magnesium zu etwa 2 % enthalten. Dort bildet es das Zentralatom des Chlorophylls. Bei Magnesiummangel vergeilen Pflanzen ebenso wie auch bei Lichtmangel. Auch dem menschlichen Körper muss Magnesium täglich in ausreichender Menge zugeführt werden, um Magnesiummangel vorzubeugen.
Der Körper eines Erwachsenen enthält etwa 20 g Magnesium (zum Vergleich: 1000 g Calcium). Im Blutplasma ist das Magnesium zu 40 % an Proteine gebunden; der normale Serumspiegel beträgt 0,8–1,1 mmol/l. Magnesium ist an circa 300 Enzymreaktionen als Enzymbestandteil oder Coenzym beteiligt. Zudem beeinflussen freie Mg-Ionen das Potential an den Zellmembranen und fungieren als second messenger im Immunsystem. Sie stabilisieren das Ruhepotential von erregbaren Muskel- und Nervenzellen und der Zellen des autonomen Nervensystems. Magnesiummangel löst Ruhelosigkeit, Nervosität, Reizbarkeit, Konzentrationsmangel, Müdigkeit, allgemeines Schwächegefühl, Kopfschmerzen, Herzrhythmusstörungen und Muskelkrämpfe aus. Es kann auch zum Herzinfarkt kommen. Im Bereich Stoffwechsel und Psyche wird vermutet, dass Magnesiummangel Depression und schizophrene Psychosen verstärkt. Ein Magnesiumüberschuss im Blut kann durch exzessive Zufuhr und Nierenfunktionsstörungen auftreten und führt zu Störungen im Nervensystem und Herz.
Die Magnesiumresorption findet zuerst im oberen Dünndarm statt, aber auch im übrigen Verdauungstrakt. Es wird über die Nieren ausgeschieden und ist in unterschiedlichen Mengen in allen Nahrungsmitteln sowie im Trinkwasser enthalten. Die erforderliche Tagesdosis von circa 300 mg wird in der Regel durch eine ausgewogene Ernährung erreicht. Ein erhöhter Bedarf kann über Nahrungsergänzungsmittel oder Medikamente gedeckt werden. Leichter Magnesiummangel ist durch schwere Erkrankung, Schwangerschaft oder Leistungssport möglich. Schwere Mangelzustände treten bei Nierenfunktionsstörungen, langandauerndem Durchfall, chronischen Darmentzündungen, schlecht eingestelltem Diabetes mellitus, Kortikoiden, bestimmten Diuretika oder Alkoholismus mit Fehlernährung auf.
Magnesiumsalze wie etwa Citrat, Gluconat, Aspartat und Aspartathydrochlorid sind in Deutschland als Arzneimittel zugelassen, und zwar in Tages-Dosen von 100 bis 400 mg gegen Mangelzustände und neuromuskuläre Störungen wie beispielsweise Muskelkrämpfe, Migräne oder Schwangerschaftskomplikationen. Nebenwirkungen sind Magen-Darm-Beschwerden und Durchfall, bei Überdosierung auch Müdigkeit und Pulsverlangsamung. Kontraindikationen sind Nierenfunktionsstörung sowie bestimmte Herzrhythmusstörungen.
Bei oraler Aufnahme von Magnesiumpräparaten (Tabletten, Kau- oder Lutschtabletten, Granulat zum Auflösen in Flüssigkeit) ist zum einen die Dosierung wichtig. Verschiedene Studien kommen zu dem Ergebnis, dass bei einer Einnahme von 120 mg circa 35 % resorbiert werden, jedoch bei Einnahme einer kompletten Tagesdosis von 360 mg nur noch circa 18 %. Für die Resorption im Körper ist die Form der heute in Medikamenten gebräuchlichen Verbindungen unerheblich, denn sie sind sowohl pharmakologisch als auch biologisch und klinisch äquivalent; organische Salze wie etwa Magnesiumaspartat oder Magnesiumcitrat werden dabei lediglich schneller vom Körper aufgenommen als anorganische Verbindungen. Zum anderen verbleibt das zusätzliche Magnesium nur dann nutzbringend im Körper, wenn auch genug bindende Moleküle im Körper zur Verfügung stehen; dies geschieht durch biochemische Anpassungen erst nach längerer Erhöhung des Magnesiumangebotes bzw. Einnahme über wenigstens vier Wochen. Magnesiumsulfat („Bittersalz“) war früher als Abführmittel gebräuchlich. Magnesiumsalze finden in der Alternativmedizin Verwendung.
Lebensmittel
Magnesium dient etwa 300 verschiedenen Proteinen als Cofaktor, vor allem bei ATP- und Nukleinsäure-bindenden Enzymen. Die empfohlene tägliche Zufuhr von Magnesium beträgt beim Menschen je nach Alter und Geschlecht zwischen 24 und 400 mg pro Tag.
Magnesium kommt als Verbindung in vielen Lebensmitteln vor, insbesondere in Vollkornprodukten (zum Beispiel Vollkornbrot, Vollkorn-Nudeln, Vollkorn-Reis, Haferflocken, Cornflakes), Mineralwasser, insbesondere Heilwasser, Leitungswasser ausreichender Wasserhärte, Leber, Geflügel, Speisefisch, Kürbiskernen, Sonnenblumenkernen, Schokolade, Cashewnüssen, Erdnüssen, Kartoffeln, Spinat, Kohlrabi, Beerenobst, Orangen, Bananen, Sesam, Zuckerrübensirup, Milch und Milchprodukten.
Gefahren und Schutzmaßnahmen
Die Gefährlichkeit von elementarem Magnesium hängt stark von der Temperatur und der Teilchengröße ab: kompaktes Magnesium ist bei Temperaturen unterhalb des Schmelzpunktes ungefährlich, während Magnesiumspäne und -pulver leichtentzündlich sind. Bedingt durch die große Oberfläche können letztere leicht mit dem Sauerstoff der Luft reagieren. Bei sehr feinem Magnesiumpulver besteht die Gefahr der Selbstentzündung; Luft-Pulver-Gemische sind sogar explosionsgefährlich. Phlegmatisierung ist eine die Gefahr herabsetzende Behandlung bei der Verarbeitung von Magnesium-, wie Metallpulvern überhaupt. Geschmolzenes Magnesium entzündet sich ebenfalls von selbst an der Luft. Auch mit vielen anderen Stoffen, beispielsweise Wasser und anderen sauerstoffhaltigen Verbindungen, reagiert feinkörniges oder erhitztes Magnesium. Magnesiumschmelzen bedürfen daher einer permanenten Sicherung gegen Zutritt von Luftsauerstoff. In der Praxis erfolgt dies durch Abdeckung der Schmelze mittels magnesiumchloridreichen Mitteln. Schwefelhexafluorid ist ebenfalls als Oxidationsschutz geeignet. Das früher übliche Abdecken mit elementarem Schwefel wird wegen der starken Belästigung durch entstehendes Schwefeldioxid nicht mehr praktiziert.
Bei Magnesiumbränden treten Temperaturen bis zu etwa 3000 °C auf. Keinesfalls dürfen gängige Löschmittel wie Wasser, Kohlenstoffdioxid, Schaum oder Stickstoff verwendet werden, da Magnesium heftig mit diesen reagiert. Bei Zutritt von Wasser zu einem Magnesiumbrand besteht die akute Gefahr einer Knallgasreaktion.
Für den Brand (Metallbrände) einer Schmelze gilt das Löschprinzip des Erstickens, also die rasche Sauerstoffverdrängung. Im einfachsten Fall durch Abdecken mit trockenem Sand, sonst mittels Aufbringung eines Abdecksalzes für Magnesiumschmelzen. Weiter geeignet sind Löschpulver der Brandklasse D, Magnesiumoxid-Pulver (Magnesia usta/gebrannte Magnesia), notfalls auch trockene rostfreie Graugussspäne.
Bei der Verwendung von Magnesium sind insofern alle gegebenen Sicherheitshinweise genau zu befolgen. Es darf unter keinen Umständen eine explosive Atmosphäre (Magnesiumstaub, Wasserstoff, Aerosole und Dämpfe brennbarer Kühlschmierstoffe) entstehen. Auch die normalen Arbeitsschutzmaßnahmen, wie die Vermeidung von Zündquellen, müssen beachtet werden.
Nachweis
Der Nachweis von Magnesium gelingt am besten mittels Magneson II, Titangelb oder Chinalizarin.
Zum Nachweis mit Magneson II (4-(4-Nitrophenylazo)-1-naphthol) wird die Ursubstanz in Wasser gelöst und alkalisch gemacht. Danach gibt man einige Tropfen einer Lösung des Azofarbstoffs Magneson II hinzu. Bei Anwesenheit von Magnesium-Ionen entsteht ein dunkelblauer Farblack. Andere Erdalkalimetalle sollten vorher durch Fällung als Carbonate entfernt werden.
Zum Nachweis mit Titangelb (Thiazolgelb G) wird die Ursubstanz in Wasser gelöst und angesäuert. Anschließend wird sie mit einem Tropfen der Titangelb-Lösung versetzt und mit verdünnter Natronlauge alkalisch gemacht. Bei Anwesenheit von Magnesium entsteht ein hellroter Niederschlag. Nickel-, Zink-, Mangan- und Cobalt-Ionen stören diesen Nachweis und sollten vorher als Sulfide gefällt werden.
Zum Nachweis mit Chinalizarin wird die saure Probelösung mit zwei Tropfen der Farbstofflösung versetzt. Dann wird verdünnte Natronlauge bis zur basischen Reaktion zugegeben. Eine blaue Färbung oder Fällung zeigt Magnesium an.
Als Nachweisreaktion für Magnesiumsalze kann auch die Bildung von Niederschlägen mit Phosphatsalz-Lösungen herangezogen werden. Die schwermetallfreie, mit Ammoniak und Ammoniumchlorid auf pH 8 bis 9 gepufferte Probelösung wird dazu mit Dinatriumhydrogenphosphatlösung versetzt. Eine weiße, säurelösliche Trübung durch Magnesiumammoniumphosphat MgNH4PO4 zeigt Magnesiumionen an:
Aus ammoniakalischer Lösung kann Mg2+ auch mit Oxin als schwerlösliche gelbgrünliche Verbindung nachgewiesen werden. Dieser Nachweis eignet sich für den Kationentrennungsgang.
Verbindungen
In Verbindungen kommt Magnesium fast ausschließlich als zweiwertiges Kation mit dem Oxidationszustand 2 vor.
Oxide und Hydroxide
Magnesiumoxid (Magnesia) bildet farblose Kristalle in der Natriumchlorid-Struktur. In der Natur kommt es als vulkanisches Mineral Periklas vor. Es sind weiße bis graue, durch Einschlüsse auch dunkelgrüne, glasglänzende reguläre Kristalle. Es wird Lebensmitteln als Säureregulator oder Trennmittel zugesetzt und hat außerdem verschiedene technische Anwendungen in Labors und in der Industrie. In der Medizin wird es zur Substitutionstherapie verwendet.
Magnesiumhydroxid ist ein farbloses, stark basisches Salz und kommt in der Natur als Mineral Brucit vor. Es hat eine trigonale Kristallstruktur in der Raumgruppe P3m1 (Raumgruppen-Nr. 164) und wird als Speiseölzusatz (zum Abbinden von Schwefeldioxid), als Flockungsmittel für die Abwasseraufbereitung, als Flammschutzmittel in thermoplastischen Kunststoffen (Polyolefinen, Polyvinylchlorid) und Elastomeren sowie als Zusatzstoff in Reinigungsmitteln verwendet. In der Medizin kommt es als Antazidum zur Neutralisierung der Magensäure und als mildes Abführmittel zum Einsatz.
Magnesiumperoxid ist eine feinpulvrige, farblose Verbindung, die eine Pyrit-Kristallstruktur in der Raumgruppe Pa3 (Raumgruppen-Nr. 205). Es ähnelt Calciumperoxid und setzt durch kontrollierte Reaktion mit wässrigen Lösungen Sauerstoff frei. Es hat verschiedene Anwendungen in der Landwirtschaft, Pharmazie und Kosmetik.
Halogenide
Magnesiumchlorid ist stark hygroskopisch und kommt in der Natur im Mineral Bischofit (MgCl2 · 6 H2O), als Doppelsalz Carnallit (KMgCl3 · 6 H2O), im Meerwasser und in Salzseen vor. Es kristallisiert im trigonalen Kristallsystem in der Raumgruppe R3m (Raumgruppen-Nr. 166). In der Lebensmitteltechnik wird es als Säureregulator, Festigungsmittel, Geschmacksverstärker, Trägerstoff oder Trennmittel eingesetzt. Magnesiumchlorid-Hexahydrat kann als thermische Batterie Wärmeenergie speichern und wieder abgeben.
Magnesiumfluorid bildet farblose Kristalle, die tetragonal in der Rutilstruktur in der Raumgruppe P42/mnm (Raumgruppen-Nr. 136) Raumgruppe kristallisieren. Seine optischen Eigenschaften machen es zusammen mit seiner chemischen Stabilität zu einem wichtigen Werkstoff für optische Anwendungen.
Magnesiumbromid und Magnesiumiodid sind ebenfalls hygroskopische Salze, die in eine trigonale Kristallstruktur in der Raumgruppe P3m1 (Raumgruppen-Nr. 164) aufweisen.
Weitere anorganische Verbindungen
Magnesiumcarbonat kommt in der Natur in großen Mengen als Magnesit (Bitterspat) vor. Es kristallisiert trigonal in der Raumgruppe R3c (Raumgruppen-Nr. 167). In der Lebensmittelindustrie wird es als Säureregulator, Trägerstoff oder Trennmittel zugesetzt. Es wird beim Klettern und Turnen eingesetzt und ist auch unter den Namen Magnesia und Chalk bekannt. Die Athleten trocknen sich dann darin vor dem Übungsbeginn die Handinnenflächen, damit ihre Haut beim Umfassen der Holme von Barren oder der Eisenstangen von Reck oder Langhantel nicht zu stark haftet. Außerdem hat es medizinische und industrielle Anwendungen.
Magnesiumnitrat ist ein farbloses, hygroskopisches Salz, das gut löslich in Wasser ist. Das Hexahydrat (Mg(NO3)2 · 6 H2O) besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14). Es wird als Dünger, Latentwärmespeicher (als Hexahydrat) oder in der Keramikindustrie eingesetzt.
Magnesiumsulfat-Heptahydrat (Mg(SO4) · 7 H2O) ist bekannt als Mineral Epsomit (Bittersalz). Es bildet farblose Kristalle, die ein rhombisch pseudotetragonales Kristallgitter ausbilden. Die Kristalle blühen oft in faserigen Aggregaten aus und bilden Stalaktiten. Es wird für Düngemittel, als Trocknungsmittel und für medizinische Anwendung verwendet.
Magnesiumphosphate (Magnesiumdihydrogenphosphat (Mg(H2PO4)2), Magnesiumhydrogenphosphat (MgHPO4) und Magnesiumphosphat (Mg3(PO4)2)) werden in der Industrie als keramischer Rohstoff und als Flammschutzmittel verwendet. In der Lebensmittelindustrie werden sie als Futtermittelzusatz, Abführmittel und Lebensmittelzusatz eingesetzt. Lebensmitteln werden sie als Säureregulator oder Trennmittel zugesetzt.
Spinell ist ein häufig vorkommendes Mineral aus der Mineralklasse der Oxide und Hydroxide mit der idealisierten chemischen Zusammensetzung MgAl2O4 und ist damit chemisch gesehen ein Magnesium-Aluminat. Es kristallisiert isotyp mit Magnetit im kubischen Kristallsystem in der Raumgruppe Fd3m (Raumgruppen-Nr. 227).
Dolomit ist ein sehr häufig vorkommendes Mineral aus der Mineralklasse der Carbonate und Nitrate mit der chemischen Zusammensetzung CaMg[CO3]2 und ist damit chemisch gesehen ein Calcium-Magnesium-Carbonat. Es kristallisiert im trigonalen Kristallsystem in der Raumgruppe R3 (Raumgruppen-Nr. 148).
Magnesiumhydrid kann als Wasserstoff- und Ernergiespeicher eingesetzt werden. Durch Wasserstoff, der aus Magnesiumhydrid freigesetzt wird, kann ein Metallschaum mit interessanten Eigenschaften, der leichter als Wasser ist, erzeugt werden.
Weitere interessante kristalline Magnesiumverbindungen sind zum Beispiel Magnesiumdiborid, Magnesiumcarbid, Magnesiumnitrid, Magnesiumsulfid, Magnesiumsilicid, Magnesiumgermanid, Magnesiummetasilicat, Magnesiumtitanoxid und Magnesiumpolonid.
Magnesiumorganyle
Magnesiumorganyle sind metallorganische Verbindungen, in denen eine Bindung zwischen Magnesium und Kohlenstoff existiert. Unter den Magnesiumorganylen kommt Grignard-Verbindungen (R-Mg-X) die weitaus größte Bedeutung zu. Eine deutlich untergeordnete Rolle spielen binäre Magnesiumorganyle sowie Alkenylmagnesiumhalogenide.
Organylmagnesiumhalogenide
Organylmagnesiumhalogenide (meist Grignard-Verbindung genannt) werden im Direktverfahren durch die Reaktion von Organylhalogeniden mit Magnesiumspänen gewonnen. Grignard-Verbindungen stehen in Lösung im Schlenk-Gleichgewicht. Sie reagieren unter Halogen-Organyl-Substitution zu Elementorganylen:
Allgemein:
z. B. :
oder unter Addition von Organylen mit Mehrfachbindungssystemen:
Allgemein:
z. B.:
Binäre Magnesiumorganyle (R2Mg, auch Magnesium-diorganyle genannt) können auf verschiedene Art erzeugt werden:
durch Transmetallierung, beispielsweise von Quecksilberdiorganylen:
durch Dismutation bei der Verschiebung des Schlenk-Gleichgewichtes mit Hilfe von 1,4-Dioxan:
Auch Magnesacyclen (cyklische Alkane mit einem Magnesium im Ring) sind mit Hilfe von 1,4-Dioxan darstellbar.
durch Metathese von Grignard-Verbindungen mit Lithium-Organylen
durch Hydromagnesierung (Addition von MgH2 an 1-Alkene):
durch die Anlagerung von elementarem Magnesium an C=C-Doppelbindungen bei einigen ungesättigten Kohlenwasserstoffen wie 1,3-Butadien oder Anthracen (Metalladdition). Möglich ist beispielsweise die Reaktion von 1,3-Butadien in Tetrahydrofuran bei Raumtemperatur:

Das erzeugte Magnesium-Butadien, auch (2-Buten-1,4-diyl)magnesium genannt, kann als Quelle für Butadien-Anionen in weiteren Synthesen dienen. Analog dazu wird das orangegelbe Magnesiumanthracen dargestellt. Magnesiumanthracen kann anschließend als Katalysator für Hydrierung von Magnesium benutzt werden.
Alkenylmagnesiumhalogenide
Alkine reagieren im Rahmen der sogenannten Carbomagnesierung mit Alkinen zu Alkenylmagnesiumhalogeniden:

Weitere organische Verbindungen
Magnesiumhydrogencitrat und Trimagnesiumdicitrat sind Magnesiumsalze der Citronensäure. Magnesiumcitrat wird als Arzneimittel eingesetzt.
Magnesiummonoperoxyphthalat ist ein Desinfektionsmittel zur Flächendesinfektion.
Magnesiumstearat ist das Magnesiumsalz der Stearinsäure und gehört zu den Kalkseifen. Es besteht aus einem Magnesium-Ion und zwei langkettigen Stearat-Ionen.
Magnesium Preis
Magnesium Preise -> Preise für Strategische Metalle
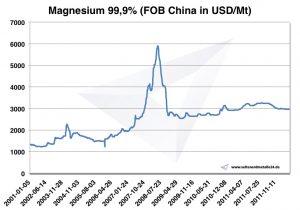
Chart Magnesium 2001-2011












