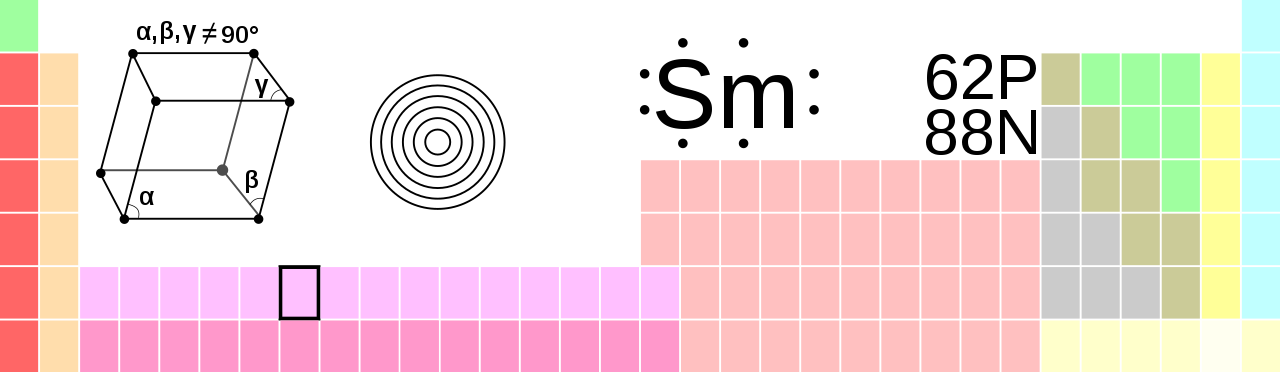
Samarium, Sm, Ordnungszahl 62
Allgemeines
Samarium (nach dem Mineral Samarskit, das wiederum benannt nach dem Bergingenieur W. M. Samarski) ist ein chemisches Element mit dem Elementsymbol Sm und der Ordnungszahl 62. Im Periodensystem steht das silbrig glänzende Element in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der seltenen Erden.
Zur Entdeckung des Samariums gibt es in der Literatur mehrere Darstellungen.
1. 1853 wies der Schweizer Jean Charles Galissard de Marignac Samarium spektroskopisch anhand einer scharfen Absorptionslinie im Didymoxid nach. 1879 isolierte der Franzose Paul Emile Lecoq de Boisbaudran das Element aus dem Mineral Samarskit ((Y,Ce,U,Fe)3(Nb,Ta,Ti)5O16). Mineral- und Elementbezeichnung leiten sich ab von dem russischen Berginspektor (Bergbaubeamten) Oberst Samarsky, der das Mineral entdeckte.
2. 1878 entdeckt der schweizerische Chemiker Marc Delafontaine Samarium, das er Decipum nennt, im Didymiumoxid. 1879 entdeckt unabhängig von ihm Paul Emile Lecoq de Boisbaudran Samarium. 1881 zeigt Delafontaine, dass sein isoliertes Element neben Samarium ein weiteres Element enthält.
3. Die unter 1 erwähnte spektroskopische Entdeckung von 1853 durch Marignac wurde 1878 von Paul Emile Lecoq de Boisbaudran gemacht.
1903 stellte der deutsche Chemiker Wilhelm Muthmann metallisches Samarium durch Elektrolyse her.
Natürlich kommt elementares Samarium nicht vor. Einige Mineralien wie Monazit, Bastnäsit und Samarskit enthalten jedoch das Element. Monazit enthält bis zu 1 % Samarium.
Gewinnung
Ausgehend vom Monazit oder Bastnäsit erfolgt die Auftrennung der Seltenen Erden über Ionentausch, Solvent-Extraktion oder elektrochemische Deposition. In einem letzten Verfahrensschritt wird das hochreine Samariumoxid mit metallischem Lanthan zum Metall reduziert und absublimiert.
Besonderheiten
In Luft ist Samarium halbwegs beständig, es bildet eine passivierende, gelbliche Oxidschicht aus. Metallisch glänzendes Samarium entzündet sich oberhalb von 150 °C. Mit Sauerstoff reagiert es zum Sesquioxid Sm2O3. Mit Wasser reagiert es heftig unter Bildung von Wasserstoff und Samariumhydroxid. Die beständigste Oxidationsstufe ist wie bei allen Lanthanoiden +3. Samarium kommt in drei Modifikationen vor. Die Umwandlungspunkte liegen bei 734 °C und 922 °C. Sm3+-Kationen färben wässrige Lösungen gelb.
Es existieren vier stabile und 19 instabile, radioaktive Isotope. Die häufigsten natürlichen Isotope sind 152Sm (26,7 %), 154Sm (22,7 %) und 147Sm (15 %).
Verwendung
Zusammen mit anderen Seltenen Erden für Kohle-Lichtbogenlampen für Filmvorführanlagen.
Dotieren von Calciumfluorid-Einkristallen für Maser und Laser.
Wegen seines großen Wirkungsquerschnitts für thermische und epithermische Neutronen wird Samarium als Neutronen-Absorber in nuklearen Anwendungen verwendet.
Samarium-Cobalt-Magnete :
Permanentmagnete aus SmCo5 weisen einen hohen Widerstand gegen Entmagnetisierung auf sowie eine Koerzitivfeldstärke von bis zu 2200 kA/m. Die verbesserte Legierung Sm2Co17 ist in der Herstellung aufwendiger, weist aber höhere magnetische Eigenschaften und eine verbesserte Korrosionsbeständigkeit auf.
Verwendung finden sie in Schrittmotoren für Quarzuhren, Antriebsmotoren in Kleinsttonbandgeräten (Walkman, Diktiergeräten), Kopfhörern, Sensoren, Kupplungen in Rührwerken und Festplattenlaufwerken. Als gewichtssparende Magnetwerkstoffe werden sie auch in der Luft- und Raumfahrt verwendet.
Samariumoxid wird optischem Glas zur Absorption von infrarotem Licht zugesetzt.
Samariumverbindungen nutzt man zur Sensibilisierung von (Leucht-) Phosphor bei Bestrahlung mit infrarotem Licht.
Als Katalysator; Samariumoxid katalysiert die Hydrierung und Dehydrierung von Ethanol (Alkohol).
In der Medizin wird das Isotop 153Samarium in Verbindung mit einem Bisphosphonat (Lexidronam) zur Behandlung von Knochenschmerzen bei Krebserkrankungen eingesetzt (Radionuklidtherapie bei Knochenmetastasen).
Verbindungen mit Samarium in der weniger günstigen Oxidationsstufe +2 (insbesondere Samarium(II)-iodid und Samarium(II)-bromid) finden Anwendung in der organischen Synthese (Reduktionsmittel und Ein-Elektronen-Transferreagenz, z. B. samariumvermittelte Pinakol-Kupplungen).
In Verbindung mit dem Radiopharmakon Ethylendiamintetra(methylenphosphonsäure) in der Nuklearmedizin zur palliativen Therapie von Knochen- und Skelettmetastasen.
| Allgemein | |
| Name, Symbol
Ordnungszahl |
Samarium, Sm, 62 |
| Serie | Lanthanoide |
| Gruppe, Periode, Block | La, 6, f |
| Aussehen | silbrig weiß |
| CAS-Nummer | 7440-19-9 |
| Massenanteil an der Erdhülle | 6 ppm |
| Atomar | |
| Atommasse | 150,36 u |
| Atomradius | 185 pm |
| Kovalenter Radius | 198 pm |
| Elektronenkonf. | [Xe] 4f(6) 6s2 |
| 1. Ionisierungsenergie | 544,5 KJ/mol |
| 2. Ionisierungsenergie | 1070 KJ/mol |
| 3. Ionisierungsenergie | 2260 KJ/mol |
| Physikalisch | |
| Aggregatszustand | fest |
| Kristallstruktur | trigonal |
| Dichte | 7,536 g/cm3 (25 °C) |
| Magnetismus | paramagnetisch (χm = 1,12 * 10(-3)) |
| Schmelzpunkt | 1345 K (1072 C) |
| Siedepunkt | 2076 K (1803 C) |
| Molares Volumen | 19,98 * 10(-6)m(3)/mol |
| Verdampfungswärme | 175 KJ/mol |
| Schmelzwärme | 8,6 KJ/mol |
| Elektrische Leitfähigkeit | 1,06*10(6) A/(V*m) |
| Wärmeleitfähigkeit | 13 W/(m*K) |
Samarium Preise
Preise für Samarium -> Preise für seltene Erden
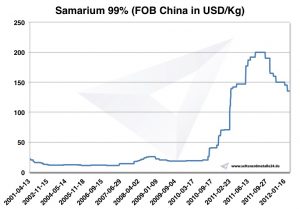
Chart Samarium 2001-2012
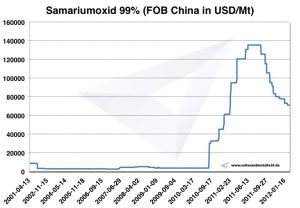
Chart Samariumoxid 2001-2012