Praseodym, Pr, Ordnungszahl 59
Allgemeines
Praseodym ist ein chemisches Element mit dem Elementsymbol Pr und der Ordnungszahl 59. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der seltenen Erden. Von der Grünfärbung seiner Verbindungen kommt auch der Name: das griechische Wort prásinos bedeutet „lauchgrün“, didymos „doppelt“ oder „Zwilling“.
1841 extrahierte Carl Gustav Mosander die seltene Erde Didym aus Lanthanoxid. 1874 bemerkte Per Teodor Cleve, dass es sich bei Didym eigentlich um zwei Elemente handelte. Im Jahr 1879 isolierte Lecoq de Boisbaudran Samarium aus Didym, das er aus dem Mineral Samarskit gewann. 1885 gelang es Carl Auer von Welsbach, Didym in Praseodym und Neodym zu trennen, die beide Salze mit verschiedenen Farben bilden.
Praseodym kommt als Begleiter in den typischen Seltenen-Erd-Mineralien Cerit, Monazit und Bastnäsit vor. Die weltweiten Reserven werden auf 4 Millionen Tonnen geschätzt.
Gewinnung
Wie bei allen Lanthanoiden werden zuerst die Erze durch Flotation angereichert, danach die Metalle in entsprechende Halogenide umgewandelt und durch fraktionierte Kristallisation, Ionenaustausch oder Extraktion getrennt. Das Metall wird durch Schmelzflusselektrolyse oder Reduktion mit Calcium gewonnen.
Besonderheiten
Praseodym ist ein weiches, silberweißes paramagnetisches Metall, welches zu den Lanthanoiden und Metallen der Seltenen Erden gehört. Es ist in Luft etwas korrosionsbeständiger als Europium, Lanthan oder Cer, bildet aber leicht eine grüne Oxidschicht aus, die an Luft abblättert. Bei 798 °C wandelt sich das hexagonale α-Pr in das kubisch-raumzentrierte β-Pr um. Natürliches Praseodym besteht nur aus dem stabilen Isotop 141Pr. 38 weitere radioaktive Isotope sind bekannt, wobei 143Pr und 142Pr mit einer Halbwertszeit von 13,57 Tagen beziehungsweise 19,12 Stunden die langlebigsten sind. Alle anderen Isotope haben Halbwertszeiten von weniger als 5,985 Stunden, die meisten sogar weniger als 33 Sekunden. Es gibt auch 6 metastabile Zustände, wobei 138mPr (t½ 2,12 Stunden), 142mPr (t½ 14,6 Minuten) und 134mPr (t½ 11 Minuten) die stabilsten sind.
Die Isotope bewegen sich einem Atommassenbereich von 120,955 (121Pr) bis 158,955 (159Pr). Wegen seiner Luftempfindlichkeit sollte Praseodym unter Benzin oder in Kunststoff oder Glas versiegelt aufbewahrt werden.
Eine biologische Bedeutung ist nicht bekannt, Praseodymverbindungen sollen aber leicht leberschädigend wirken. Es gibt allerdings keine Toxizitätswerte.
Praseodym tritt in seinen Verbindungen drei- und vierwertig auf, wobei die dreiwertige Oxidationszahl die häufigere ist. Pr(III)-Ionen sind gelbgrün, Pr(IV)-Ionen farblos. Unter besonderen reduktiven Bedingungen kann auch zweiwertiges Praseodym realisiert werden, z. B. im Pr2I5.
Bekannt sind von allen Stufen mehrere Halogenide beispielsweise PrF3, PrF4, PrCl3, PrBr3, PrI3, Pr2I5. Die dreiwertigen Halogenide bilden verschiedene Hydrate.
Es gibt auch diverse Verbindungen mit Chalkogenen: das normale braun-schwarze Praseodym(III,IV)-oxid Pr6O11, das fast schwarze PrO2, das grüne Pr2O3, Pr2S3, Pr2Te3 und andere binäre Verbindungen wie PrN, PrP. Daneben ist Praseodym in diversen Salzen, wie dem hygroskopischem Praseodymnitrat Pr(NO3)3 · x H2O, dem schön kristallisierenden Praseodymsulfat Pr2(SO4)2 · 8 H2O und anderen vertreten.
Außerdem bildet es mehrere Fluoridokomplexe wie z. B. das K2[PrF6] mit vierwertigem Pr.
Verwendung
Praseodym wird in Legierungen mit Magnesium zur Herstellung von hochfestem Metall für Flugzeugmotoren verwendet.
Legierungen mit Cobalt und Eisen sind starke Dauermagnete.
Praseodymverbindungen werden zum Färben von Glas und Emaille verwendet (zum Beispiel in grün gefärbten Scheinwerfergläsern in der Beleuchtungstechnik).
Die Verbindungen verbessern auch die UV-Absorption und werden für Augenschutzgläser beim Schweißen benutzt.
| Allgemein | |
| Name, Symbol
Ordnungszahl |
Praseodym, Pr, 59 |
| Serie | Lanthanoide |
| Gruppe, Periode, Block | La, 6, f |
| Aussehen | silbrig weiß, gelblich |
| CAS-Nummer | 7440-10-0 |
| Massenanteil an der Erdhülle | 5,2 ppm |
| Atomar | |
| Atommasse | 140,90765 u |
| Atomradius | 185 pm |
| Kovalenter Radius | 203 pm |
| Elektronenkonf. | [Xe] 4f(3) 6s2 |
| 1. Ionisierungsenergie | 527,0 KJ/mol |
| 2. Ionisierungsenergie | 1020 KJ/mol |
| 3. Ionisierungsenergie | 2086 KJ/mol |
| Physikalisch | |
| Aggregatszustand | fest |
| Kristallstruktur | hexagonal |
| Dichte | 6,475 g/cm3 (25 °C) |
| Magnetismus | paramagnetisch (χm = 2,9 * 10(-3)) |
| Schmelzpunkt | 1208 K (935 C) |
| Siedepunkt | 3563 K (3290 C) |
| Molares Volumen | 20,80 * 10(-6)m(3)/mol |
| Verdampfungswärme | 330 KJ/mol |
| Schmelzwärme | 6,9 KJ/mol |
| Elektrische Leitfähigkeit | 1,43*10(6) A/(V*m) |
| Wärmeleitfähigkeit | 13 W/(m*K) |
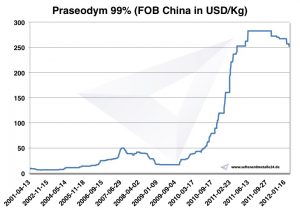
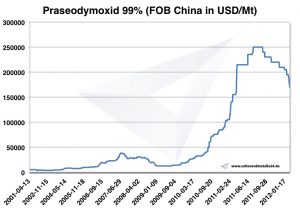
Praseodym Preis
Preise für Praseodym -> Preise für seltene Erden